Białko adaptera transportu pęcherzykowego
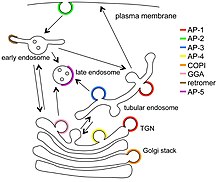
Białka adaptera transportu pęcherzykowego to białka zaangażowane w tworzenie kompleksów, które działają w transporcie cząsteczek z jednej lokalizacji subkomórkowej do drugiej. Kompleksy te koncentrują odpowiednie cząsteczki ładunku w pęcherzykach , które pączkują lub wystają z jednej organelli i przemieszczają się do innego miejsca, w którym ładunek jest dostarczany. Chociaż niektóre szczegóły dotyczące tego, w jaki sposób te białka adaptorowe osiągają swoją specyficzność w handlu, zostały opracowane, wciąż pozostaje wiele do nauczenia się.
Istnieje kilka ludzkich zaburzeń związanych z defektami składników tych kompleksów, w tym choroby Alzheimera i Parkinsona .
Białka
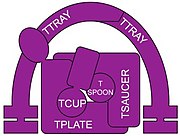
Większość białek adaptorowych to heterotetramery . W kompleksach AP znajdują się dwa duże białka ( ∼ 100 kD ) i dwa mniejsze białka. Jedno z dużych białek jest określane jako β ( beta ), z β1 w kompleksie AP-1, β2 w kompleksie AP-2 i tak dalej. Inne duże białko ma różne oznaczenia w różnych kompleksach. W AP-1 nosi nazwę γ ( gamma ), AP-2 ma α ( alfa ), AP-3 ma δ ( delta ), AP-4 ma ε ( epsilon ), a AP-5 ma ζ ( zeta ). Dwa mniejsze białka to średnia podjednostka o nazwie μ ( mu ∼ 50 kD) i mała podjednostka σ ( sigma ∼ 20 kD), nazwane od 1 do 5, odpowiadające 5 kompleksom AP. Składniki COPI (cop one) powłoka i TSET (T-set) kompleks transportujący błonę mają podobne heterotetramery kompleksów AP.
Retromer nie jest blisko spokrewniony, został poddany przeglądowi, a jego białka nie będą tutaj opisywane. GGA (lokalizacja Golgiego, homologia domeny ucha z adaptacją gamma, białka wiążące ARF) to grupa pokrewnych białek (trzy u ludzi), które działają jako monomeryczne białka adaptera klatryny w różnych ważnych transportach pęcherzyków błonowych , ale nie są podobne do żadnego z kompleksy AP i nie będą szczegółowo omawiane w tym artykule. Stoniny (niepokazane na głównym rysunku) są również monomerami podobnymi pod pewnymi względami do GGA i również nie będą szczegółowo omawiane w tym artykule.
PTB to domeny białkowe , które obejmują NUMB , DAB1 i DAB2 . Epsyna i AP180 w domenie ANTH to inne białka adaptorowe, które zostały poddane przeglądowi.
Ważny kompleks transportowy, COPII , nie został pokazany na głównym rysunku. Kompleks COPII jest heteroheksamerem, ale nie jest blisko spokrewniony z kompleksami AP/TSET. Poszczególne białka kompleksu COPII nazywane są SEC , ponieważ są kodowane przez geny zidentyfikowane w sekrecyjnych mutantach drożdży. Szczególnie interesującym aspektem COPII jest to, że może tworzyć typowe kuliste pęcherzyki i kanaliki do transportu dużych cząsteczek, takich jak kolagen prekursorów, które nie mieszczą się w typowych kulistych pęcherzykach. Struktura COPII została omówiona w otwartym artykule i nie będzie przedmiotem tego artykułu. Są to przykłady znacznie większego zestawu adapterów ładunkowych.
Rozważania ewolucyjne
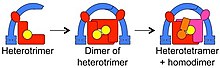
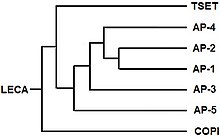
Najnowszy wspólny przodek ( MRCA) eukariontów musiał mieć mechanizm przemieszczania cząsteczek między błonami wewnętrznymi a organellami i zgłoszono prawdopodobną tożsamość zaangażowanego kompleksu adaptera. Uważa się, że MRCA miał 3 białka zaangażowane w handel i że tworzyły heterotrimer. Ten heterotrimer następnie „dimeryzował”, tworząc 6-członowy kompleks. Poszczególne komponenty dalej zmieniały się w obecne kompleksy, w pokazanej kolejności, przy czym AP1 i AP2 były ostatnimi, które się rozeszły.
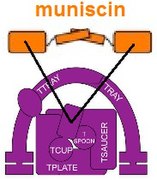
Ponadto wydaje się, że jeden składnik TSET, muniscyna , znana również jako białko TCUP, wyewoluował w część białek opisthokontów ( zwierząt i grzybów ). Części kompleksów AP ewoluowały w części białek GGA i stonin. Istnieją dowody wskazujące, że części kompleksu porów jądrowych i COPII mogą być ewolucyjnie powiązane.
Tworzenie pęcherzyków transportowych
Najlepiej scharakteryzowanym typem pęcherzyka jest pęcherzyk pokryty klatryną (CCV). Powstawanie pęcherzyka COPII w retikulum endoplazmatycznym i jego transport do ciałka Golgiego . Zaangażowanie heterotetrameru COPI jest podobne do tego w sytuacji AP / klatryny, ale płaszcz COPI nie jest blisko spokrewniony z płaszczami pęcherzyków CCV ani COPII. AP-5 jest związany z 2 białkami, SPG11 i SPG15 , które wykazują pewne strukturalne podobieństwo do klatryny i może tworzyć płaszcz wokół kompleksu AP-5, ale ultrastruktura tego płaszcza nie jest znana. Herb AP-4 jest nieznany.
Niemal uniwersalną cechą składania płaszcza jest rekrutacja różnych kompleksów adapterów do błony „dawcy” przez białko Arf1 . Jedynym znanym wyjątkiem jest AP-2, który jest rekrutowany przez określony lipid błony komórkowej .
Inną niemal uniwersalną cechą montażu płaszczy jest to, że adaptery są rekrutowane najpierw, a następnie rekrutują płaszcze. Wyjątkiem jest COPI, w którym 7 białek jest rekrutowanych do błony jako heptamer.
Jak pokazano na załączonym obrazie, wytwarzanie powlekanego pęcherzyka nie jest natychmiastowe, a znaczna część czasu dojrzewania jest wykorzystywana do wykonywania „nieudanych” lub „daremnych” interakcji, dopóki nie wystąpi jednocześnie wystarczająca liczba interakcji, aby umożliwić dalszy rozwój struktury .
Ostatnim etapem tworzenia się pęcherzyka transportowego jest „szczypanie” błony dawcy. Wymaga to energii, ale nawet w dobrze zbadanym przypadku CCV nie wszystkie wymagają dynamin . Załączona ilustracja przedstawia przypadek AP-2 CCV, jednak AP-1 i AP-3 CCV nie używają dynamin.
Wybór cząsteczek ładunku
To, które cząsteczki ładunku są włączone do określonego typu pęcherzyka, zależy od określonych interakcji. Niektóre z tych interakcji zachodzą bezpośrednio z kompleksami AP, a niektóre pośrednio z „alternatywnymi adapterami”, jak pokazano na tym diagramie . Na przykład białka błonowe mogą oddziaływać bezpośrednio, podczas gdy białka rozpuszczalne w świetle organelli dawcy wiążą się pośrednio z kompleksami AP, wiążąc się z białkami błonowymi, które przechodzą przez błonę i wiążą się na swoim końcu światła z pożądaną cząsteczką cargo. Wydaje się, że cząsteczki, które nie powinny znajdować się w pęcherzyku, są wykluczone przez „stłoczenie molekularne”.
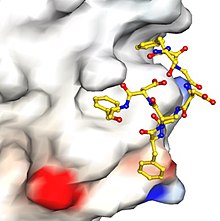
„Sygnały” lub „motywy” aminokwasów w białkach ładunkowych, które oddziałują z białkami adaptorowymi, mogą być bardzo krótkie. Na przykład dobrze znanym przykładem jest dileucyny , w którym po reszcie aminokwasu leucyny (aa) następuje bezpośrednio inna reszta leucyny lub izoleucyny . Jeszcze prostszym przykładem jest tyrozynie , który ma wartość YxxØ (przy reszcie y rozyny oddzielonej 2 resztami aa od innego nieporęcznego, hydrofobowego pozostałość aa). Załączony rysunek pokazuje, jak niewielka część białka może oddziaływać specyficznie z innym białkiem, więc te krótkie motywy sygnałowe nie powinny być zaskakujące. Rodzaj porównań sekwencji użytych częściowo do zdefiniowania tych motywów.
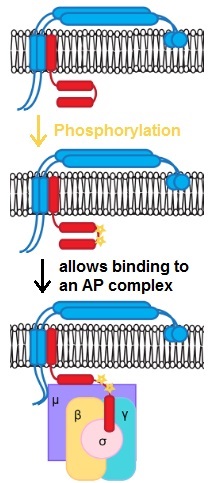
W niektórych przypadkach modyfikacje potranslacyjne , takie jak fosforylacje (pokazane na rysunku), są ważne dla rozpoznania ładunku.
Choroby
Dokonano przeglądu chorób adaptera .
AP-2/CCV biorą udział w autosomalnej recesywnej hipercholesterolemii poprzez powiązane białko adaptera receptora lipoprotein o małej gęstości 1 .
Retromer bierze udział w recyklingu składników błony plazmatycznej. Znaczenie tego recyklingu w synapsie jest zasugerowane na jednej z figur w galerii. Istnieją co najmniej 3 sposoby, w jakie dysfunkcja retromeru może przyczyniać się do zaburzeń mózgu, w tym chorób Alzheimera i Parkinsona.
AP-5 jest ostatnio opisanym kompleksem, a jednym z powodów wspierających ideę, że jest to autentyczny kompleks adaptera, jest to, że jest związany z dziedziczną spastyczną paraplegią , podobnie jak AP-4. AP-1 jest powiązany z zespołem MEDNIK . AP-3 jest powiązany z zespołem Hermansky'ego-Pudlaka . COPI jest powiązany z chorobą autoimmunologiczną . COPII wiąże się z dysplazją czaszkowo-soczewkowo-szwową . Jedno z białek GGA może być zaangażowane w chorobę Alzheimera.
Galeria
Zobacz też
Notatki
Linki zewnętrzne
- Kolaż mikrografii elektronowych przedstawiających pęcherzyki COPI, COPII i klatryny
- struktura płaszcza COPI z tej publikacji, bezpłatnie z bezpłatną rejestracją
- Filmowy opis CLSD choroby COPII
- Filmy iBiology autorstwa Kai Simons o lipidach , tratwach lipidowych i handlu komórkowym