Związki prazeodymu
Związki prazeodymu to związki utworzone przez prazeodym metaliczny lantanowców (Pr). W tych związkach prazeodym ogólnie wykazuje stopień utlenienia +3 , taki jak PrCl3 , Pr(NO3 ) 3 i Pr( CH3COO ) 3 . Znane są jednak związki zawierające prazeodym na stopniach utlenienia +2 i +4 oraz w przeciwieństwie do innych lantanowców na stopniu utlenienia +5.
Tlenki
Prazeodym może tworzyć tlenki na wiele różnych sposobów, chociaż jedynymi tlenkami, które są stabilne w temperaturze pokojowej, są Pr 2 O 3 , Pr 6 O 11 i PrO 2 . Tlenek prazeodymu(III) to zielony proszek tworzący sześciokątne kryształy i krystalizujący w tlenku manganu(III) lub biksytu . Tlenek prazeodymu(IV) można wytworzyć przez gotowanie Pr 6 O 11 w wodzie lub kwasie octowym :
- Pr 6 O 11 + 3 H 2 O → 4 PrO 2 + 2 Pr(OH) 3
Tlenek prazeodymu (III, IV) jest najbardziej stabilną formą tlenków prazeodymu w temperaturze i ciśnieniu otoczenia . Jest rozpuszczalny w wodzie i ma sześcienną strukturę fluorytu . Można go wytworzyć metodami w stanie stałym, takimi jak termoliza, metoda stopionej soli, kalcynacja lub wytrącanie .
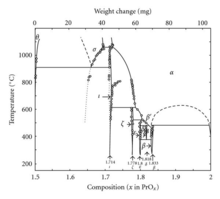
Oprócz Pr 6 O 11 prazeodym tworzy także układ tlenków w różnych fazach:
| Wartość | Formuła | Faza | x w Prox | Średni stopień utlenienia Pr |
|---|---|---|---|---|
| 4 | Pr 2 O 3 | θ | 1,5 | 3 |
| 7 | Pr 7 O 12 | ι | 1,714 | 3.428 |
| 9 | Pr 9 O 16 | ζ | 1,778 | 3,556 |
| 10 | Pr 5 O 9 | ε | 1.8 | 3.6 |
| 11 | Pr 11 O 20 | δ | 1,818 | 3,636 |
| 12 | Pr 6 O 11 | β | 1,833 | 3,667 |
| ∞ | Pro 2 | 2 | 4 |
Halogenki
Prazeodym metaliczny reaguje ze wszystkimi stabilnymi halogenami , tworząc zielone trihalogenki:
- 2 Pr (s) + 3 F 2 (g) → 2 PrF 3 (s)
- 2 Pr (s) + 3 Cl 2 (g) → 2 PrCl 3 (s)
- 2 Pr (s) + 3 Br 2 (g) → 2 PrBr 3 (s)
- 2 Pr (s) + 3 I 2 (g) → 2 PrI 3 (s)
Fluorek prazeodymu (III) jest najbardziej stabilnym fluorkiem prazeodymu. Można przygotować reakcję między azotanem prazeodymu (III) i fluorkiem sodu, w wyniku której powstanie fluorek prazeodymu (III) w postaci zielonej krystalicznej substancji stałej. Chlorek prazeodymu (III) jest jasnozieloną substancją stałą, którą można wytworzyć przez traktowanie metalicznego prazeodymu chlorowodorem . Zwykle oczyszcza się go poprzez sublimację próżniową. Jest to kwas Lewisa , zaliczany do „twardych” według koncepcji HSAB . Szybkie nagrzewanie hydratu może powodować niewielkie ilości hydrolizy . PrCl 3 tworzy stabilny kompleks kwasowo-zasadowy Lewisa K 2 PrCl 5 w reakcji z chlorkiem potasu ; związek ten wykazuje ciekawe właściwości optyczne i magnetyczne .
Bromek prazeodymu (III) jest jedynym stabilnym bromkiem prazeodymu. Przyjmuje UCl 3 . Jony prazeodymu mają 9 współrzędnych i przyjmują trójboczną geometrię pryzmatyczną . Długości wiązań prazeodymu i bromu wynoszą 3,05 Å i 3,13 Å. Jodek prazeodymu (III) można wytworzyć przez ogrzewanie prazeodymu i jodu w obojętnej atmosferze, w wyniku czego powstaje jodek prazeodymu (III) lub przez ogrzewanie prazeodymu z jodkiem rtęci (II). Tworzy rombowe kryształy, które są higroskopijne . Krystalizuje w PuBr 3 z grupą przestrzenną Cmcm (nr 63) z a = 4,3281(6) Å, b = 14,003(6) Å i c = 9,988(3) Å.
tetrafluorek PrF 4 , który wytwarza się w wyniku reakcji mieszaniny fluorku sodu i fluorku prazeodymu(III) z gazowym fluorem , w wyniku czego powstaje Na 2 PrF 6 , po czym fluorek sodu usuwa się z mieszaniny reakcyjnej za pomocą ciekłego fluorowodoru . Dodatkowo prazeodym tworzy dwujodek brązu ; podobnie jak dijodki lantanu, ceru i gadolinu , jest to związek elektrody prazeodymu (III) .
Związki organoprazeodymowe
Związki organoprazeodymowe to związki posiadające wiązanie prazeodymu z węglem . Związki te są bardzo podobne do związków innych lantanowców , ponieważ wszystkie mają wspólną niezdolność do ulegania wiązaniom zwrotnym π . Są one zatem ograniczone głównie do przeważnie jonowych cyklopentadienidów (izostrukturalnych z lantanem) oraz prostych alkili i aryli z wiązaniami σ, z których niektóre mogą być polimerowe. Chemia koordynacyjna prazeodymu jest w dużej mierze chemiczna dla dużego, elektrododatniego jonu Pr 3+ , a zatem jest w dużej mierze podobna do chemii innych wczesnych lantanowców La 3+ , Ce3 + i Nd3 + . Na przykład, podobnie jak lantan, cer i neodym, azotan prazeodymu tworzy kompleksy 4:3 i 1:1 z 18-koroną-6 , podczas gdy środkowe lantanowce od prometu do gadolinu mogą tworzyć tylko kompleks 4:3, a później lantanowce od terbu do lutetu nie może skutecznie koordynować wszystkich ligandów. Takie kompleksy prazeodymu mają wysokie, ale niepewne liczby koordynacyjne i słabo zdefiniowaną stereochemię, z wyjątkami wynikającymi z wyjątkowo dużych ligandów, takich jak trójkoordynacyjny [Pr{N(SiMe 3 ) 2 } 3 ] Istnieje również kilka mieszanych tlenków i fluorków obejmujących prazeodym (IV), ale nie ma on zauważalnej chemii koordynacyjnej na tym stopniu utlenienia, jak jego sąsiad cer. Jednakże niedawno opisano pierwszy przykład molekularnego kompleksu prazeodymu (IV). Podobnie jak inne związki organolantanowców, właściwości związków organoprazeodymowych obejmują:
- Związki organoprazeodymowe są bardzo wrażliwe na powietrze i wodę oraz piroforyczne .
- Chemistry in the 0 stopniu utlenienia is far more limited. In fact, their electropositive nature makes their organometallic compounds more likely to be ionic.
- Związki organoprazeodymowe nie tworzą stabilnych karbonylków w temperaturze pokojowej; związki karbonyloorganiczne zaobserwowano tylko w matrycach argonu i rozkładają się po podgrzaniu do 40 K.
Kompleksy związane σ
Wiązania σ metal-węgiel występują w alkilach preeodymu, takich jak [PrMe 6 ] 3- i Pr [CH(SiMe 3 ) 2 ] 3 .
Kompleksy ze wiązaniami π
Kompleksy cyklopentadienylowe są znane z prazeodymu. Można go wytworzyć według następującego schematu reakcji:
- 3 Na[Cp] + PrCl 3 → Pr[Cp] 3 + 3 NaCl
Związki te mają ograniczone zastosowanie i zainteresowanie akademickie.
Aplikacje
Azotek prazeodymu(III) stosowany jest w wysokiej klasy produktach elektrycznych i półprzewodnikowych oraz jako surowiec do produkcji luminoforu. Jest również stosowany jako materiał magnetyczny i materiał docelowy do rozpylania. Wiele związków prazeodymu, takich jak szczawian prazeodymu (III) , stosuje się do barwienia niektórych szkieł i emalii. Po zmieszaniu z niektórymi innymi materiałami szczawian prazeodymu (III) barwi szkło na intensywnie żółto.
Tlenek prazeodymu (III, IV) ma wiele potencjalnych zastosowań w katalizie chemicznej i często jest stosowany w połączeniu z promotorem, takim jak sód lub złoto , w celu poprawy jego działania katalitycznego. Ma wysoką stałą dielektryczną K wynoszącą około 30 i bardzo niskie prądy upływowe, co czyni go również obiecującym materiałem do wielu potencjalnych zastosowań w nanourządzeniach i mikroelektronice .