Związki ołowiu
Związki ołowiu występują z ołowiem na dwóch głównych stopniach utlenienia: +2 i +4. To pierwsze jest bardziej powszechne. Nieorganiczne związki ołowiu (IV) są zazwyczaj silnymi utleniaczami lub występują tylko w silnie kwaśnych roztworach.
Chemia
Różne utlenione formy ołowiu są łatwo redukowane do metalu. Przykładem jest ogrzewanie PbO z łagodnymi organicznymi środkami redukującymi, takimi jak glukoza. Mieszanina tlenku i siarczku podgrzana razem również utworzy metal.
- 2 PbO + PbS → 3 Pb + SO2
Ołów metaliczny jest atakowany (utleniany) tylko powierzchownie przez powietrze, tworząc cienką warstwę tlenku ołowiu, który chroni go przed dalszym utlenianiem. Metal nie jest atakowany przez kwasy siarkowe ani chlorowodorowe . Rozpuszcza się w kwasie azotowym z wydzielaniem gazowego tlenku azotu , tworząc rozpuszczony Pb(NO 3 ) 2 .
- 3 Pb + 8 H + + 8 NIE
- 3 → 3 Pb 2+ + 6 NIE
- 3 + 2 NIE + 4 H 2 O
Po podgrzaniu z azotanami metali alkalicznych metaliczny ołów utlenia się, tworząc PbO (znany również jako litarge ), pozostawiając odpowiedni azotyn metalu alkalicznego . PbO jest reprezentatywne dla stopnia utlenienia +2 ołowiu. Jest rozpuszczalny w kwasach azotowym i octowym , z których roztworów można wytrącić halogenki , siarczany , chromiany , węglany (PbCO 3 ) i węglany zasadowe ( Pb
3 (OH)
2 (CO
3 )
2 ) sole ołowiu. Siarczek można również wytrącić z roztworów octanowych . Wszystkie te sole są słabo rozpuszczalne w wodzie. Wśród halogenków jodek jest mniej rozpuszczalny niż bromek, który z kolei jest mniej rozpuszczalny niż chlorek.
Tlenek ołowiu (II) jest również rozpuszczalny w roztworach wodorotlenków metali alkalicznych , tworząc odpowiednią sól pionbitu .
- PbO + 2OH − + H2O → Pb (OH)
2− 4
Chlorowanie roztworów pionbitu powoduje powstawanie ołowiu na stopniu utlenienia +4.
-
Pb(OH)
2− 4 + Cl 2 → PbO 2 + 2 Cl − + 2 H 2 O
Dwutlenek ołowiu jest reprezentatywny dla stopnia utlenienia +4 i jest silnym środkiem utleniającym . Chlorek na tym stopniu utlenienia powstaje z trudem i łatwo rozkłada się na chlorek ołowiu (II) i chlor gazowy. Bromek i jodek ołowiu (IV) nie są znane. Dwutlenek ołowiu rozpuszcza się w roztworach wodorotlenków metali alkalicznych, tworząc odpowiednie ołowianki .
- PbO 2 + 2 OH − + 2 H 2 O → Pb(OH)
2− 6
Ołów ma również tlenek o mieszanych stopniach utlenienia +2 i +4, czerwony ołów ( Pb
3 O
4 ), znany również jako minia .
Ołów łatwo tworzy równomolowy stop z metalicznym sodem , który reaguje z halogenkami alkilowymi , tworząc metaloorganiczne związki ołowiu, takie jak tetraetyloołów .
Tlenki i siarczki
Znane są trzy tlenki: PbO , Pb 3 O 4 (czasami nazywany " miniem ") i PbO 2 . Ten pierwszy ma dwa alotropy: α-PbO i β-PbO, oba o strukturze warstwowej i tetrakoordynacyjnym ołowiu. Alotrop alfa ma kolor czerwony i ma odległość Pb – O 230 pm; alotrop beta ma kolor żółty i ma odległość Pb – O 221 i 249 pm (ze względu na asymetrię). Dzięki podobieństwu oba alotropy mogą istnieć w standardowych warunkach (beta z małymi ( 10-5 względne) zanieczyszczeń, takich jak Si, Ge, Mo itp.). PbO reaguje z kwasami, tworząc sole, a z zasadami, dając plumbity, [Pb(OH) 3 ] − lub [Pb(OH) 4 ] 2− .
Dwutlenek można wytworzyć np. przez halogenowanie soli ołowiu(II). Alotrop alfa jest romboedryczny , a alotrop beta jest czworokątny . Oba alotropy mają kolor czarno-brązowy i zawsze zawierają trochę wody, której nie można usunąć, ponieważ ogrzewanie również powoduje rozkład (do PbO i Pb 3 O 4 ). Dwutlenek jest silnym utleniaczem: może utleniać kwasy solny i siarkowy. Nie reaguje z roztworem alkalicznym, ale reaguje ze stałymi alkaliami, dając hydroksyplumbaty, lub z tlenkami zasadowymi, dając plumbaty.
Reakcja ołowiu z siarką lub siarkowodorem daje siarczek ołowiu. Ciało stałe ma strukturę podobną do NaCl (prosty sześcienny), którą utrzymuje do temperatury topnienia 1114 ° C (2037 ° F). Jeśli ogrzewanie zachodzi w obecności powietrza, związki rozkładają się, dając tlenek i siarczan. Związki te są prawie nierozpuszczalne w wodzie, słabych kwasach i (NH 4 ) 2 S/(NH 4 ) 2 S 2 rozwiązanie jest kluczem do oddzielenia ołowiu od pierwiastków grup analitycznych I do III, cyny, arsenu i antymonu. Związki rozpuszczają się w kwasie azotowym i kwasie chlorowodorowym, dając odpowiednio elementarną siarkę i siarkowodór. Ogrzewanie mieszanin tlenku i siarczku tworzy metal.
- 2 PbO + PbS → 3 Pb + SO2 ↑
Halogenki i inne sole
Ogrzewanie węglanu ołowiu z fluorowodorem daje fluorowodorek, który po stopieniu rozkłada się do difluorku. Ten biały krystaliczny proszek jest lepiej rozpuszczalny niż dijodek, ale mniej niż dibromek i dichlorek. Nie istnieją skoordynowane fluorki ołowiu (z wyjątkiem niestabilnego kationu PbF + ). Tetrafluorek, żółty krystaliczny proszek, jest niestabilny.
Inne dihalogenki otrzymuje się po podgrzaniu soli ołowiu (II) z halogenkami innych metali; dihalogenki ołowiu wytrącają się, dając białe rombowe kryształy (dijodek tworzy żółte sześciokątne kryształy). Można je również otrzymać na drodze bezpośredniej reakcji pierwiastków w temperaturze przekraczającej temperatury topnienia dihalogenków. Ich rozpuszczalność wzrasta wraz z temperaturą; dodanie większej ilości halogenków najpierw zmniejsza rozpuszczalność, ale następnie zwiększa się z powodu kompleksowania z maksymalną liczbą koordynacyjną wynosi 6. Kompleksowanie zależy od liczby jonów halogenkowych, liczby atomowej metalu alkalicznego, do którego dodaje się halogenek, temperatury i siły jonowej roztworu. Czterochlorek otrzymuje się po rozpuszczeniu ditlenku w kwasie chlorowodorowym; aby zapobiec rozkładowi egzotermicznemu, trzyma się go pod stężonym kwasem siarkowym. Tetrabromek może nie istnieć, a tetrajodek zdecydowanie nie istnieje. Przygotowano również diastatyd.
Metal nie jest atakowany przez kwasy siarkowe ani chlorowodorowe . Rozpuszcza się w kwasie azotowym z wydzielaniem gazowego tlenku azotu , tworząc rozpuszczony Pb(NO 3 ) 2 . Jest to dobrze rozpuszczalna substancja stała w wodzie; kluczem jest więc otrzymywanie osadów halogenków , siarczanów , chromianów , węglanów i zasadowych węglanów Pb 3 (OH) 2 (CO 3 ) 2 soli ołowiu.
Kompleksy chlorkowe
Ołów (II) tworzy szereg kompleksów z chlorkiem , którego powstawanie zmienia chemię korozyjną ołowiu. Będzie to miało tendencję do ograniczania rozpuszczalności ołowiu w solankach .
| Pb 2+ + Cl - → PbCl + | K1 = 12,59 |
| PbCl + + Cl − → PbCl 2 | K2 = 14,45 |
| PbCl 2 + Cl - → PbCl - 3 |
K3 = 0,398 |
|
PbCl - 3 + Cl - → PbCl 2 - 4 |
K4 = 0,0892 |
Organoołów
Najbardziej znanymi związkami są dwie najprostsze pochodne plumbane : tetrametyloołów (TML) i tetraetyloołów (TEL); jednak ich homologi, jak również heksaetylodiołów (HEDL), mają mniejszą stabilność. Pochodne tetraalkilowe zawierają ołów (IV); wiązania Pb – C są kowalencyjne. Tym samym przypominają typowe związki organiczne.
Ołów łatwo tworzy równomolowy stop z metalicznym sodem , który reaguje z halogenkami alkilowymi , tworząc metaloorganiczne związki ołowiu, takie jak tetraetyloołów . Energie wiązań Pb – C w TML i TEL wynoszą tylko 167 i 145 kJ/mol; związki rozkładają się w ten sposób podczas ogrzewania, przy czym pierwsze oznaki składu TEL widoczne są w temperaturze 100 ° C (210 ° F). Piroliza daje elementarne rodniki ołowiu i alkilowe; ich wzajemne oddziaływanie powoduje syntezę HEDL. Rozkładają się również pod wpływem światła słonecznego lub promieniowania UV. W obecności chloru alkile zaczynają być zastępowane chlorkami; R2 _ PbCl 2 w obecności HCl (produkt uboczny poprzedniej reakcji) prowadzi do całkowitej mineralizacji do PbCl 2 . Reakcja z bromem przebiega na tej samej zasadzie.
Diagramy fazowe rozpuszczalności
Siarczan ołowiu(II) jest słabo rozpuszczalny, co widać na poniższym diagramie pokazującym dodanie SO
2− 4 do roztworu zawierającego 0,1 M Pb 2+ . pH roztworu wynosi 4,5, ponieważ powyżej tego stężenia Pb 2+ nigdy nie może osiągnąć 0,1 M z powodu tworzenia się Pb(OH) 2 . Zauważ, że rozpuszczalność Pb 2+ spada 10 000 razy, gdy SO
2− 4 osiąga 0,1 M.

|
|
| Wykres przedstawiający stężenie rozpuszczonego Pb 2+ w wodzie jako funkcję SO 2− 4 |
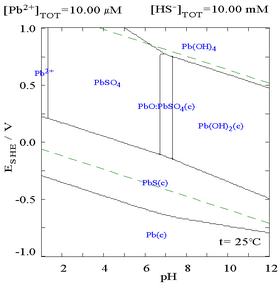
Diagram ołowiu w środowisku siarczanowym |
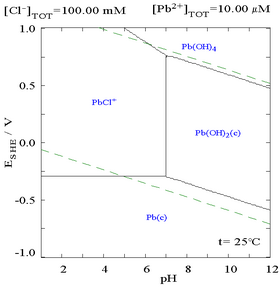
Dodatek chlorku może obniżyć rozpuszczalność ołowiu, chociaż w ośrodkach bogatych w chlorki (takich jak woda królewska ) ołów może ponownie stać się rozpuszczalny jako anionowe kompleksy chloru.

|
|
| Diagram przedstawiający rozpuszczalność ołowiu w chlorkach. Stężenia ołowiu wykreślono jako funkcję całkowitej zawartości chlorków. | Diagram Pourbaix dla ołowiu w środowisku zawierającym chlorki (0,1 M). |
Bibliografia
- Polański, NG (1986). Fillipova, NA (red.). Аналитическая химия элементов: Свинец [ Chemia analityczna pierwiastków: ołów ] (po rosyjsku). nauka .




