1,6-Metano(10)annulen

|
|
| Nazwy | |
|---|---|
|
Preferowana nazwa IUPAC
Bicyklo[4.4.1]undeka-1,3,5,7,9-pentaen |
|
| Identyfikatory | |
|
Model 3D ( JSmol )
|
|
| ChemSpider | |
|
Identyfikator klienta PubChem
|
|
|
Pulpit nawigacyjny CompTox ( EPA )
|
|
|
|
|
|
| Nieruchomości | |
| C 11 H 10 | |
| Masa cząsteczkowa | 142,201 g·mol -1 |
|
O ile nie zaznaczono inaczej, dane podano dla materiałów w stanie normalnym (przy 25°C [77°F], 100 kPa).
|
|
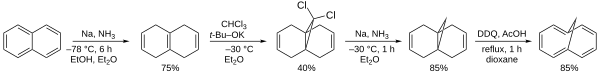
1,6-Metano[10]annulen (znany również jako 1,6-metanonaftalen lub homonaftalen ) to węglowodór aromatyczny o wzorze chemicznym C 11 H 10 . Był to pierwszy odkryty stabilny związek aromatyczny oparty na układzie cyklodekapentaenowym .
Przygotowanie
Według Organic Syntheses można go wytworzyć z naftalenu .
Aromatyczność
Jest analogiczny do cyklodekapentaenu ([10]annulen), ale z dwoma atomami wodoru zastąpionymi przez pierścieniowy mostek metylenowy (- CH
2 -). W konsekwencji spełnia regułę Hückela ( n = 2) i pomimo zniekształcenia planarności wprowadzonego przez mostek metylenowy, związek jest aromatyczny . W rzeczywistości, przygotowany przez Vogela w latach sześćdziesiątych XX wieku, był pierwszym odkrytym stabilnym aromatycznym cyklodekapentaenem. Jego aromatyczność potwierdzają trzy główne dowody. Po pierwsze, podobieństwo długości wiązań węgiel-węgiel mierzone za pomocą krystalografii rentgenowskiej jest niezgodne z naprzemiennymi wiązaniami pojedynczymi i podwójnymi . Rzeczywista struktura jest lepiej traktowana jako para hybryd rezonansowych (takich jak struktury Kekulé benzenu ), a nie jako posiadająca naprzemienne wiązania pojedyncze i podwójne.
Po drugie, jego widmo 1H NMR pokazuje wpływ diamagnetycznego prądu pierścieniowego , który jest charakterystyczny dla związków aromatycznych. Peryferyjne protony wokół pierścienia są odsłonięte , podczas gdy jądra mostków metylenowych są silnie ekranowane.
Jego energia rezonansowa jest mniejsza niż naftalenu .