Choroba Chandlera
| Choroba Chandlera | |
|---|---|
| Inne nazwy | Idiopatyczna jałowa martwica kości głowy kości udowej |
| Specjalność | Ortopedyczny |
Choroba Chandlera, znana również jako idiopatyczna jałowa martwica kości kości udowej (ANFH lub ONFH), jest rzadkim schorzeniem, w którym komórki kostne głowy kości udowej (FH) obumierają z powodu braku krwi. Choroba ta powstaje, gdy przepływ krwi jest ograniczony do części kości w pobliżu stawu. Jest to szczególnie wyjątkowe, ponieważ głowa kości udowej jest z jakiegoś powodu jedyną dotkniętą częścią ciała i rzadko przemieszcza się w dół do głównej części kości udowej. W 1948 roku FA Chandler dokonał przeglądu wielu przypadków i po raz pierwszy opublikował swoje interpretacje jako Choroba wieńcowa stawu biodrowego. Chociaż teraz wiemy, że jego termin jest niepoprawny i niewłaściwie opisuje rzeczywistą chorobę.
W obecnej praktyce pacjenci zwykle zgłaszają się z bólem stawu biodrowego po stronie choroby Chandlera. Ponieważ jest to tak rzadka diagnoza, niektóre bardziej konserwatywne metody kontroli bólu są rzadko stosowane przed zastosowaniem dogłębnych skanów prowadzących do postawienia diagnozy . Na podstawie stopnia zaawansowania umierającej kości zwykle dyktuje przebieg leczenia. Wiele z bardziej zachowawczych metod leczenia prowadzi do wymiany całego stawu biodrowego w ciągu życia pacjenta, ale istnieje obietnica uratowania umierającej kości lub prawidłowego wyleczenia, jeśli zostanie wykryta odpowiednio wcześnie. Obecnie niewiele jest badań nad leczeniem tej choroby, ponieważ nie zagraża ona bezpośrednio życiu, a nawet najbardziej inwazyjne opcje prowadzą do umiarkowanej jakości życia. Większość badań koncentruje się bardziej na ustaleniu, czy istnieje kombinacja zachowawczych metod leczenia, które razem mogą zastąpić bardziej inwazyjne opcje leczenia jako preferowaną metodę leczenia na późniejszych etapach.
Symptomy i objawy
Obraz kliniczny Chandlersa lub ANFH zazwyczaj przebiega bezobjawowo we wczesnych stadiach. W miarę postępu choroby u pacjentów może wystąpić w pachwinie , który może promieniować do kolana i/lub pośladka po tej samej stronie ciała, inaczej zwanego pośladkiem. W najcięższych nieleczonych przypadkach pacjent może nie być w stanie chodzić, stać lub siedzieć z powodu zwiększonej ekspozycji nerwów na martwe części kości. W badaniu fizykalnym pacjenci zwykle zgłaszają się z ograniczonym zakresem ruchu w biodrze i skarżą się na ból, zwłaszcza przy wymuszonej rotacji wewnętrznej . Wiele osób nie będzie wiedziało, że je ma, aż do dalszych badań diagnostycznych. Ci, którzy go mają, zostaną zdiagnozowani, chyba że samoistnie wyleczy się, co jest rzadkością. Pacjenci zwykle przechodzą przez kilka rund leczenia i testów, zanim zostaną zamówione bardziej szczegółowe skany i postawiona zostanie pełna diagnoza. Albo to, albo powtórne skanowanie może pokazać degenerację , co zachęci do dokładniejszego zbadania. Oznaki i objawy tego stanu są tak podobne do innych, że bardziej powszechne stany są leczone lub wykluczane w pierwszej kolejności.
Etiologia i patogeneza
Obecna etiologia lub pochodzenie tej choroby nie jest znane. W niektórych badaniach wysunięto teorię, że przebudowa kości jest utrzymywana w mikrośrodowisku w FH, co oznacza, że istnieje większy lokalny składnik zmian w głowie kości udowej niż normalny ogólnoustrojowy sposób, w jaki przebudowa kości jest obsługiwana w całym ciele. Jako całość nasze ciało przechodzi przebudowę kości przy użyciu różnych hormonów i glukokortykoidów , aby zrównoważyć wchłanianie i produkcję kości w całym ciele. Uważa się, że część lokalna jest częściowo kontrolowana przez komórki zapalne zwane cytokinami i poszczególne czynniki wzrostu . Teoria głosi, że lokalna przebudowa kości działa nieprawidłowo i przytłacza ogólnoustrojową przebudowę kości, powodując, że FH jest wysoce podatny na martwicę . Badania wykazały, że istnieją czynniki ryzyka , które są bardziej niż prawdopodobne związane z rozwojem choroby, ale wiele z nich ma bardzo szeroki zakres i obejmuje duże grupy ludzi, na przykład alkoholików , diabetyków i wiele innych powszechnych chorób podstawowych . Niestety, większość z nich jest klasyfikowana jako idiopatyczna , ponieważ nie można naprawdę zawęzić pochodzenia, dlaczego dzieje się to tylko z głową kości udowej. Większość klinicystów zauważa, że głowa kości udowej wydaje się mieć prawie własny system, nieco oddzielony od reszty kości udowej. Istnieje wiele teorii wyjaśniających, w jaki sposób głowa kości udowej umiera, w przeciwieństwie do tego, dlaczego tak się dzieje.
Mechanizmy nietraumatyczne
Głównym mechanizmem są czynniki zewnętrzne powodujące mikrozatory w naczyniach, prowadzące do okluzji naczyń lub w inny sposób, które mogą powodować niedokrwienie głowy kości udowej. Czynniki zewnętrzne, które mogą powodować te zatory , mogą obejmować alkohol, krążenie lipidów , duże dawki glukokortykoidów i nowy wzrost komórek tłuszczowych w szpiku kostnym . Okluzja naczyń może być również spowodowana postępem choroby, który zwiększa krzepnięcie i powstawanie skrzepów w naczyniach. Zaburzenia krzepnięcia i zaburzenia krwinek czerwonych mogą również prowadzić do nieprawidłowej niedrożności naczyń. Bardzo rzadko spotykana jest jednak przyczyna niedokrwienia spowodowanego chorobą dekompresyjną lub zbyt szybkim zejściem z obszarów o wysokim ciśnieniu, co powoduje blokowanie przepływu krwi przez pęcherzyki gazu. W niezwykle rzadkim przypadku pacjent zgłasza rodzinną cechę rozwoju tego stanu. Chociaż czynniki genetyczne odgrywają rolę w rozwoju ANFH, same geny zwykle nie są przyczyną. W tym przypadku z Japonii rodzina miała specyficzną autosomalną dominującą mutację, która doprowadziła do uszkodzenia kolagenu typu II , a tym samym do niskiej stabilności kości i ANFH. Chociaż w tym przypadku podkreśla to konkretną przyczynę, nadal nie jesteśmy pewni, w jaki sposób i dlaczego obejmuje ona wyłącznie głowę kości udowej.
Traumatyczny
Uraz można sklasyfikować jako złamanie lub zwichnięcie FH. Może to prowadzić do uszkodzenia pozakostnego lub zewnętrznego dopływu krwi do kości. Jest to szczególnie powszechne w przypadku złamań w połączeniu między FH a szyjką kości udowej, zwanym regionem podstolikowym. Uraz w regionie podgłowowym przerywa połączenie lub zespolenie między zewnętrznymi naczyniami krwionośnymi na końcu kości lub bocznymi naczyniami nasadowymi , powodując słaby przepływ krwi do FH. Wreszcie, bezpośrednie napromieniowanie , chemioterapia lub stres oksydacyjny mogą prowadzić do nieprawidłowego działania komórek, ostatecznie prowadząc do śmierci komórek.
Diagnoza
W tej chwili ANFH można zdiagnozować tylko za pomocą rezonansu magnetycznego biodra i prześwietlenia biodra, szczególnie w pozycjach przednio-tylnej i bocznej żabiej nogi. Wraz z tymi skanami należy wykonać dodatkowy skan kości, który pozwala lekarzom zobaczyć aktywność komórek kostnych w ciele. Po uzyskaniu obrazów, których oczekuje lekarz, są one następnie mierzone za pomocą dwóch przeglądów systematycznych.
System klasyfikacji Ficat i Arlet składa się z czterech etapów, opartych na standardowych radiogramach
| System klasyfikacji Ficat i Arlet | |
|---|---|
| Inscenizacja | Wymagania |
| Etap 0 | Normalne zdjęcie rentgenowskie i MRI bez objawów |
| I etap | Niewielka osteopenia na zdjęciu rentgenowskim, obrzęk na rezonansie magnetycznym i zwiększone wychwyty kostne na skanie kości |
| II etap | Na zdjęciu rentgenowskim i rezonansie magnetycznym zarys FH prawidłowy, ale z objawami przebudowy kości oraz zmianami sklerotycznymi i torbielowatymi. Scyntygrafia kości nadal wykazywałaby zwiększoną absorpcję. |
| Etap III | Rentgen i MRI wskazują na oznaki zapadnięcia się podchrzęstnej , znaku półksiężyca lub spłaszczenia FH |
| Etap IV | MRI i RTG wykazują zwężenie szpary stawowej z wtórnymi zmianami zwyrodnieniowymi panewki , czyli panewki stawu biodrowego wchodzącej w skład miednicy, takie jak torbiele, osteofity i destrukcja chrząstki. |
System klasyfikacji Steinberga rozszerza system Ficat na sześć etapów i obejmuje ilościowe określenie zaangażowania FH na każdym etapie.
| System klasyfikacji Steinberga | ||
|---|---|---|
| Inscenizacja | Inscenizacja podrzędna | Wymagania |
| Etap 0 | Normalne zdjęcie rentgenowskie i MRI bez objawów | |
| I etap | Normalne zdjęcie rentgenowskie, ale nieprawidłowy rezonans magnetyczny i/lub scyntygrafia kości | |
| Etap I.A | < 15% FH biorących udział w nieprawidłowym skanie uważanym za łagodny | |
| Etap IB | 15% do 30% FH zaangażowanych w nieprawidłowy skan uważany za umiarkowany | |
| Etap IC | 30% FH jest zaangażowanych w nieprawidłowy skan uważany za ciężki | |
| II etap | Zdjęcia rentgenowskie i/lub MRI wykazują mieszankę osteopenii i/lub stwardnienia rozsianego i/lub torbieli podchrzęstnych, bez jakiejkolwiek przejrzystości podchrzęstnej | |
| Etap III | < 15% FH biorących udział w nieprawidłowym skanie uważanym za łagodny | |
| Etap IIB | 15% do 30% FH zaangażowanych w nieprawidłowy skan uważany za umiarkowany | |
| Etap IIC | > 30% FH jest zaangażowanych w nieprawidłowy skan uważany za ciężki | |
| Etap III | Rentgen i/lub MRI pokazują znak półksiężyca | |
| Etap IIIa | Łagodne załamanie podchrzęstne poniżej FH < 15% | |
| Etap IIIb | Umiarkowane, zapaść podchrzęstna poniżej FH 15% do 30% | |
| Etap IIIC | Ciężkie załamanie podchrzęstne poniżej FH > 30% | |
| Etap IV | Rentgen i MRI wykazujące spłaszczenie FH | |
| Etap IVA | Łagodne < 15% spłaszczenia FH | |
| Etap IVB | umiarkowane 15% do 30% spłaszczenia FH | |
| Etap IVC | Ciężkie > 30% spłaszczenia FH | |
| Etap V | Zwężenie przestrzeni stawowej | |
| Etap VA | Łagodne < 15% zwężenia | |
| Etap VB | umiarkowane zwężenie od 15% do 30%. | |
| Scena VC | Ciężkie > 30% zwężenia | |
Ponadto Association Research Circulation Osseous (ARCO) zasugerowało nowy system klasyfikacji oparty na połączeniu wyników radiograficznych, MRI, scyntygrafii kości i wyników badań histologicznych. Jednak najwyraźniej te dwa systemy klasyfikacji, Ficat i ARCO, wciąż nie są wystarczająco wiarygodne, aby ocenić status samego ONFH.
Epidemiologia
ONFH jest nowo diagnozowany w Stanach Zjednoczonych od 10 do 20 tysięcy razy w roku. Najczęściej występuje u osób w wieku od 20 do 50 lat, z grubsza zgadza się to z wieloma badaniami. Ze względu na to, że jest to tak rzadkie zjawisko i rzadko badane, wiele badań ma różne liczby. Wiele badań dotyczy populacji w Japonii, Stanach Zjednoczonych i innych krajach. Stosunek diagnoz męskich do żeńskich wynosi odpowiednio 5:1 do 2,1:1, co oznacza, że prawdopodobieństwo wystąpienia tej choroby u mężczyzny jest 2-5 razy większe niż u kobiety. Niektórzy odkryli dużą korelację między palaczami a zarażeniem się ONFH w późniejszym stadium. Jedno z badań wykazało, że spośród ich uczestników powyżej 30% miało czynnik ryzyka związany z alkoholem, który ich zdaniem odgrywał możliwy czynnik rozwoju martwicy. Chociaż te statystyki mogą być alarmujące, większość z nich ma miejsce w społeczności, która ma ANFH. Wydaje się, że nie różni się między rasami lub że jest zaraźliwy między ludźmi. W porównaniu z populacją krajową i światową choroba ta dotyka znikomą liczbę ludzi na świecie. Duża liczba osób dotkniętych tym schorzeniem lub już ma problemy zdrowotne, a odsetek osób, które mają je z przyczyn dziedzicznych, jest niezwykle mały w porównaniu ze wszystkimi populacjami.
Choroby analogiczne
Chociaż choroba Chandlera jest specyficzna dla głowy kości udowej, istnieje wiele innych chorób, które są analogiczne do mechanizmu choroby Chandlera:
Zespół Legg-Calve-Perthes występuje tylko u dzieci i dotyczy głowy kości udowej podobnie jak w chorobie Chandlera.
Choroba Preisera jest ogólnie tym samym problemem, ale występuje w kości łódeczkowatej ręki.
Choroba Khölera atakuje kość łódkowatą stopy.
Choroba Keinböcka to kolejna choroba dotykająca rękę, ale raczej kość księżycowata
Leczenie
Nieoperacyjny
że leczenie zachowawcze ANFH, które uważa się za niechirurgiczne, może być skuteczne we wczesnych stadiach choroby, aw połączeniu z innymi rodzajami leczenia obserwowano lepsze wyniki niż leczenie samodzielne.
| Leczenie farmakologiczne AVN | ||
|---|---|---|
| Rodzaj medycyny | Używać | Przykład |
| środki obniżające poziom lipidów | Usunąć wszelkie lipidy blokujące naczynia | statyny |
| antykoagulanty | Zatrzymuje tworzenie się skrzepów | Enozaparyna |
| substancje wazoaktywne | Rozszerza naczynia krwionośne poprawiając przepływ krwi | prostacyklina |
| bisfosfoniany | W przebudowie kości zmniejsza aktywność osteoklastów | |
Plazmę bogatą w osocza
Osocze bogatopłytkowe (PRP) ma 8 razy więcej płytek krwi w porównaniu z krwią pełną , a także zawiera wysokie poziomy białek regeneracyjnych, czynników wzrostu. PRP pomaga w rozpoczęciu angiogenezy i osteogenezy odpowiednio bezkrwawego tworzenia i tworzenia kości, co jest ważne dla prawidłowego gojenia. PRP ma zdolność zatrzymywania odpowiedzi zapalnej wokół martwiczych części kości, aby zwiększyć komfort pacjenta i zmniejszyć ból. PRP może pomóc w zapobieganiu apoptozie lub śmierci komórek wywołanej glukokortykoidami. W rzeczywistości może odwrócić złe działanie glukokortykoidów tak bardzo, że faktycznie powoduje, że pomagają one w osteogenezie i autofagii martwiczej tkanki , która odpowiednio tworzy nową kość i powoduje, że układ odpornościowy organizmu zjada i usuwa umierającą lub martwą tkankę. Jest to jedna z lepiej przebadanych alternatywnych metod leczenia w porównaniu z innymi.
Komórki macierzyste
Terapia komórkami macierzystymi
Szpik kostny
Komórki szpiku kostnego pomagają w angiogenezie lub tworzeniu naczyń krwionośnych . Przeszczepy komórek macierzystych okazały się pewnym sukcesem i mogą stanowić opcję eksperymentalną dla pacjentów w połączeniu z innymi metodami leczenia. Wstępne wyniki nie są jeszcze ostateczne ze względu na uzyskanie wystarczająco dużej próby, ale wstępne dane wskazują na możliwą pozytywną korelację i wynik. Istnieje wiele wyzwań związanych z przeszczepami szpiku kostnego, dlatego potrzebne są dalsze badania.
Pozaustrojowe fale uderzeniowe
Pozaustrojowa terapia falą uderzeniową (ESWT) wysyła fale dźwiękowe przez tkanki miękkie i kości, powodując mikropęknięcia. Pomaga rozbić blizny i inne niezdrowe tkanki, umożliwiając zwiększoną naprawę obszaru. Wykazano, że ESWT przywraca dotlenienie tkanek , zmniejsza obrzęk lub gromadzenie się płynów oraz indukuje angiogenezę .
Impulsowe pole elektromagnetyczne
Pulse Electromagnetic Field (PEMF) wykorzystuje pulsujące pola elektromagnetyczne, aby wspomóc ruch jonów i redukcję wolnych rodników . Wraz z tym istnieje teoria, że pola magnetyczne pomagają „komunikować się z ciałem”, aby zwiększyć i poprawić funkcje organizmu, takie jak gojenie. Było wielu badaczy tej terapii, ponieważ jest stosunkowo nowa. Wyniki są obiecujące, ale nic nie jest ostateczne i w tej chwili nadal jest to eksperyment. W ortopedii PEMF stosuje się do stymulacji osteogenezy i angiogenezy .
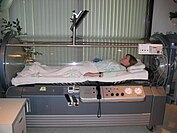
Tlen hiperbaryczny
tlenem hiperbarycznym (HBO).
Działanie hiperbarycznego tlenu HBO polega na napełnieniu szczelnego pojemnika 100% tlenem i zwiększeniu ciśnienia w komorze do bezpiecznej wartości. Ciśnienie w zasadzie powoduje i nierównowagę ciśnienia parcjalnego tlenu we krwi, zwiększając pobieranie krwi przez komórki i osocze . Ten dodatkowy tlen w organizmie w wyniku terapii zwiększa pozakomórkowe stężenie tlenu i zmniejsza niedokrwienie i obrzęk komórkowy poprzez indukowanie skurczu naczyń . Ta terapia jest droga i trudno dostępna. Samodzielnie w ograniczonych warunkach ma ograniczoną skuteczność, ale dzięki połączeniu zabiegów i odpowiedniej częstotliwości może pomóc w przyspieszeniu gojenia i rokowaniu.
Należy wspomnieć, że samo ograniczenie obciążania nie jest wystarczającym sposobem zapobiegania postępowi choroby, ale w połączeniu z powyższymi terapiami może poprawić wskaźnik powodzenia przypadków.
Chirurgiczny
American Association of Hip and Knee Surgeons stwierdziło, że całkowita alloplastyka stawu biodrowego była najczęściej stosowaną metodą leczenia w stadiach ONFH po zapaści, podczas gdy dekompresja rdzenia była najczęściej stosowaną metodą leczenia w stadiach ONFH przed zapadnięciem
Dekompresja rdzenia
Dekompresja rdzenia (CD) FH jest standardową procedurą we wczesnych stadiach ONFH. Operacja ma na celu obniżenie ciśnienia w torebce FH. W tym celu chirurg wierci otwory w martwiczej kości FH, aby pobudzić krwawienie i gojenie się FH, jednocześnie zmniejszając ciśnienie spowodowane stanem zapalnym. Połączenie CD z FH i innych niechirurgicznych metod leczenia wykazało najlepsze wyniki w przypadku CD.
Procedura oszczędzania głowy kości udowej
Procedura oszczędzania głowy kości udowej (FHSP) ma na celu próbę uratowania głowy kości udowej pacjenta zamiast usuwania całej kości. Ta procedura obejmuje dekompresję rdzenia (CD) połączoną z różnymi rodzajami przeszczepów kości i/lub mniej inwazyjnymi metodami leczenia skojarzonego. Ze względu na to, że nekrotyczna kość niszczy pierwotny kulisty kształt FH, leczenie to ma na celu zaoszczędzenie jak największej ilości kości, aby miejmy nadzieję uniknąć całkowitej wymiany stawu .
Artroplastyka
Artroplastyka połowiczo-resurfacingowa : jest stosowana tylko wtedy, gdy martwicza tkanka nie ma wpływu na powierzchnie stawowe, a chrząstka jest minimalnie uszkodzona. Pozwala to chirurgowi na wygolenie FH wywołującego wzrost, ale zachowując ten sam ogólny kształt FH
Przeszczep kości
Nieunaczynione przeszczepy kostne są wykorzystywane z wielu różnych źródeł do wypełnienia obszarów, w których znajdowała się martwa kość w FH. Wiele razy odbywa się to za pomocą otworów wykonanych podczas robienia płyty CD, co jest najczęstszym sposobem na zrobienie tego. Innym sposobem na to jest wykonanie osobnego okienka chirurgicznego do FH lub przejście przez szyjkę kości udowej . Wadą tego jest to, że podczas zabiegu biodro pacjenta musi być przemieszczone, co może później powodować problemy. Przeszczep kości może pomóc w zapobieganiu chorobie zwyrodnieniowej stawów, pomagając przywrócić część kształtu głowy kości udowej. Gdy stosuje się unaczyniony przeszczep kostny, pomaga on zwiększyć się bardziej niż inne typy, ponieważ same przeszczepy mają już zbudowane naczynia, a organizm może tworzyć z nich nowe.
Implanty tantalowe
Implanty tantalowe są stosowane z CD, a ponieważ są porowate , zapewniają doskonałe wsparcie strukturalne dla wzrostu kości. Są one najbardziej przydatne, gdy przeszczep kości powoduje zbyt duże ryzyko, ale sam CD jest zbyt niestabilny.
Wymiana biodra
Kiedy pacjenci mają późniejsze stadia ONFH, większość innych opcji leczenia nie jest skuteczna, a nawet nie jest warta wypróbowania. Tak więc jedyną opcją jest całkowita wymiana stawu biodrowego , w której zarówno FH, jak i miednicza część stawu są wymieniane lub jedna część stawu biodrowego. Wielu chirurgów decyduje się na całkowitą wymianę stawu biodrowego w niektórych łagodnych przypadkach, ponieważ proteza stawu biodrowego ma dłuższy wskaźnik powodzenia i przez większość czasu, jeśli próbujesz wykonać częściową protezę lub techniki oszczędzające FH, które nie są całkowicie skuteczne w późniejszym życiu, proteza stawu biodrowego jest potrzebne. Wiele trzeba wziąć pod uwagę, w tym wiek i postęp.
Rokowanie
W kilku badaniach wykazano, że wielkość segmentu martwiczego w FH jest podstawowym parametrem określającym rokowanie i leczenie tego stanu. Im większa ilość kości martwiczej, tym gorsze rokowanie w zakresie minimalnych wyników leczenia. Choroba sama w sobie nie prowadzi do śmierci, ale całkowicie nieleczona choroba może prowadzić do innych, bardziej problematycznych stanów, takich jak posocznica , która ponownie, jeśli nie jest leczona, doprowadzi do śmierci. Poza tym zastrzeżeniem, większość rokowań opiera się na ciężkości choroby przed leczeniem lub wybranej opcji leczenia. Ze względu na rzadkość występowania choroby istnieje niewiele badań przeglądowych, więc nie ma uzgodnionych badań, które podsumowują wszystkie opcje leczenia i ich wyniki. Niezwykle trudno jest znaleźć badania, które izolują określone plany leczenia lub badania, które porównują je z innymi. Stwierdzono, że wiele niechirurgicznych metod leczenia opóźnia progresję, ale nie wykazano żadnych danych dotyczących odwracania martwicy wraz z tymi zabiegami chirurgicznymi, które natychmiast naprawiają martwicę, ale niepowodzenie definiowano w większości jako konieczność kontynuowania bardziej inwazyjnej operacji lub wymiany stawu biodrowego w TAK .
Leczenie i rokowanie można podsumować następująco:
Nieoperacyjny
W ograniczonym badaniu 53% leczonych antykoagulantami stwierdziło, że pomogło to pacjentom przejść od etapu I do etapu II
Eksperymentalna terapia komórkami macierzystymi wykazała, że na różnych etapach po wstrzyknięciu w biodro czas do zapadnięcia się był opóźniony o 35% bardziej niż bez niego
Te, które zdecydowały się na stosowanie tylko ograniczeń w zakresie obciążania, odnotowały 90% wskaźnik niepowodzeń i prowadziły do kontynuacji martwicy
W 10-letnim badaniu ESWT zaobserwowano brak progresji we wszystkich stopniach I, 64% pacjentów w stadium II i 12% pacjentów w stadium III
Badanie PEMF trwające 28 miesięcy wykazało poprawę w stadium I i II na poziomie 94%, ale stadium III zakończyło się całkowitym niepowodzeniem
Chirurgiczny
Terapia Core Depression i PRP podczas kontroli po 5 latach wykazała 100% skuteczność w fazie I, 67% w fazie IIa i 0% w fazie IIb, z czego 68% było idiopatycznych, a 32% wtórnej martwicy kości spowodowanej innymi zabiegami lub chorobami . Dane te pochodzą z ograniczonego badania kontrolnego, a wielkość próby była bardzo mała, ale daje to obiecujące wyniki
THA na dowolnym wystawionym biodrze ma 87% wskaźnik sukcesu po 10 latach kontroli
Implanty tantalowe w połączeniu z CD na różnych etapach osiągnęły 91% skuteczność po 2 latach obserwacji i 68% po 4 latach obserwacji
Unaczyniony przeszczep kostny w różnych stadiach stwierdzono nieco ponad 30% poprawę zmian radiologicznych z ponad 50% brakiem zmian i zwiększoną martwicą u 9%
Osoby sklasyfikowane jako stadium II tylko 5-15% otrzymuje całkowitą alloplastykę stawu biodrowego
Badania
Chociaż badania bardzo rzadko dotyczą przyczyny choroby, większość jest skierowana na najlepsze kombinacje leczenia. Wielu badaczy stwierdziło, że pojedyncze leczenie zachowawcze jest w zasadzie nieskuteczne. Co ciekawe, wielu badaczy zgadza się, że połączenie leczenia zachowawczego lub nawet połączenie minimalnie inwazyjnego i zachowawczego może być tak samo dobre jak typowe leczenie. Dzieje się tak tylko w umiarkowanych przypadkach, najcięższe przypadki można leczyć tylko bardziej inwazyjnymi metodami leczenia.
Jedną ze wspomnianych technik, która jest dalej badana, jest przeszczep kości. Chociaż tradycyjne przeszczepy kości są dobrze przyjmowane, inni, którzy stosują przeszczep chrząstki, również wskazują, że dodatkowa chrząstka, która jest bardzo potrzebna, może powodować wolniejszy postęp, ponieważ jest bardziej delikatna. Niestety badania były ograniczone i są dalej badane.
Głębiej w terapię komórkami macierzystymi wchodzi wprowadzenie komórek multipotencjalnych . Komórka multipotencjalna jest mniej specyficzną komórką macierzystą kości, a teoria mówi, że komórki te mogą przekształcić się nie tylko w kość, ale także w inne typy komórek tkankowych, które zwiększą regenerację głowy kości udowej jako całości, gdy zostaną użyte razem z unaczynionymi przeszczepami kostnymi. To badanie było bardzo ograniczone, a wyniki nie były tak ostateczne, ale wstępne dane mogą prowadzić do obiecujących wyników w większym badaniu.