Choroba mięśni-oko-mózg
| Choroba mięśni-oko-mózg | |
|---|---|
| Inne nazwy | Dystrofia mięśniowa-dystroglikanopatia wrodzona z wadami mózgu i oczu A3 |
 | |
| dziedziczona autosomalnie recesywnie . | |
| Specjalność | Neurologia |
| Zwykły początek | Narodziny lub niemowlęctwo |
Choroba mięśni-oko-mózg ( MEB ) , znana również jako dystrofia mięśniowa-dystroglikanopatia wrodzona z anomaliami mózgu i oka A3 ( MDDGA3 ), jest rodzajem rzadkiej wrodzonej dystrofii mięśniowej (CMD), w dużej mierze charakteryzującej się hipotonią po urodzeniu. Pacjenci mają dystrofię mięśniową, nieprawidłowości ośrodkowego układu nerwowego i nieprawidłowości narządu wzroku. Stan jest zwyrodnieniowy.
MEB jest spowodowana mutacjami w genie POMGnT1, jest wrodzona i dziedziczona autosomalnie recesywnie . Nie ma lekarstwa na MEB. Opieka podtrzymująca koncentruje się głównie na łagodzeniu objawów, które różnią się w różnych warunkach klinicznych. Leczenie objawowe może obejmować terapie fizjologiczne, terapie zajęciowe, leki i operacje. Średnia długość życia pacjentów z MEB wynosi ponad 70 lat.
Symptomy i objawy
Główne oznaki i objawy MEB obejmują:
- Dystrofie mięśniowe: osłabienie mięśni, hipotonia, zanik mięśni
- Zaburzenia oka: brak reakcji wzrokowej, ciężka krótkowzroczność, jaskra
- Zaburzenia ośrodkowego układu nerwowego: niepełnosprawność intelektualna, wady korowe
Dystrofie mięśniowe
Najbardziej rozpowszechnionymi objawami MEB są niemowlęta rodzące się wiotkie. Odnosi się do stanu hipotonii . Rodzaje hipotonii występujące u pacjentów obejmują hipotonię uogólnioną, hipotonię rozlaną, hipotonię wrodzoną i inne podtypy. Jej przyczyną jest głównie ciężka dystrofia mięśniowa i częściowo nieprawidłowości mózgowe.
80% - 99% osób wykazuje różne miopatie . Na ogół objawiają się one silnym osłabieniem mięśni i opóźnieniem w rozwoju motorycznym. Stąd zaburzenia chodu (nieprawidłowe chodzenie) stwierdza się u 80% - 99% chorych. Znaczna część z nich ma ograniczoną mobilność, nie chodzi, a nawet nie obraca głowy. Osłabienie mięśni wpływa na mięśnie twarzy oprócz mięśni szkieletowych. W większości przypadków prowadzi to do upośledzenia mowy. [ potrzebne źródło ]
Inne objawy obejmują sztywność stawów i (lub) kręgosłupa, zmniejszenie masy mięśniowej, zmniejszone odruchy , przykurcze mięśni , spastyczność , zanik mięśni i deformacje kręgosłupa.
Zaburzenia oka
Problemy ze wzrokiem często występują u osób z MEB. Pacjenci mają niską ostrość wzroku i nie są w stanie fiksować się na bodźce wzrokowe. Zależy od nasilenia, niektóre nie wykazują żadnej reakcji wizualnej, niektóre mogą reagować na światło, a niektóre na obiekt.
Ponad 80% pacjentów zgłaszało zaburzenia widzenia. Częste problemy to jaskra , krótkowzroczność , zez („zez”) i zanik nerwu wzrokowego, które występują w 80-99%. Zanik nerwu wzrokowego obejmuje słabą pigmentację dna oka , cienkie naczynia krwionośne siatkówki, małe tarcze nerwu wzrokowego i brzeg twardówki oraz coloboma nerwu wzrokowego (zwyrodnienie nerwu wzrokowego dolnego). Zaćma dotyka 30% - 79% osób. Buphthalmos (powiększenie gałki ocznej), megalocornea (powiększenie rogówki) i oczopląs (niekontrolowane ruchy gałek ocznych) występują w rzadkich przypadkach.
Chociaż nieprawidłowości oczne w dużej mierze odpowiadają za słabe widzenie, niektóre problemy ze wzrokiem są związane z nieprawidłowościami w mózgu.
Zaburzenia ośrodkowego układu nerwowego
MEB poważnie upośledza funkcje poznawcze. Odzwierciedla to nieprawidłowy EEG i EMG u 80% - 99% osób. Przy tej samej częstotliwości wodogłowie . Ciężka postać wiąże się z uciskiem innych nerwów i powoduje więcej powikłań.
Cechy kliniczne obejmują ciężkie upośledzenie umysłowe we wszystkich aspektach. Większość osób ma niepełnosprawność intelektualną o różnym stopniu nasilenia. Odnotowano postępujące pogorszenie rozwoju behawioralnego. Padaczka i drgawki występują u 30% - 79% chorych.
Częste są również objawy wad strukturalnych. Często występuje hipoplazja śródmózgowia , mostu , móżdżku i rdzenia . Aplazja może wystąpić na szczycie hipoplazji . Zgłaszano przypadki spłaszczenia pnia mózgu, ventriculomegalii , pachygyrii , bezmózgowia typu II . W tempie od 5% do 29% u pacjentów występuje również holoprosencefalia i przepuklina oponowa .
Wygląd zewnętrzny
Charakterystyczne cechy twarzy dla MEB to wydatne czoło, wyłupiaste oko i wąskie obszary skroniowe.
Powoduje
MEB jest spowodowane mutacjami genu β1,2-N-acetyloglukozaminylotransferazy 1 (POMGnT1) związanego z białkiem O-mannozy. Patogenne warianty mutują gen i prowadzą do dysfunkcji enzymu POMGnT1. Obecnie istnieje 14 zidentyfikowanych klinicznie mutacji, których lokalizacje są rozproszone i rozproszone w całym genie POMGnT1. Różne mutacje zaobserwowano u pacjentów z MEB z różnych krajów, a mianowicie z Finlandii, Szwecji, Norwegii, Estonii, USA, Izraela, Hiszpanii i Włoch. Od 14 pacjentów spoza Finlandii zidentyfikowano 9 różnych typów mutacji.
Lokalizacja mutacji jest nieznacznie skorelowana z nasileniem objawów w zakresie nieprawidłowości strukturalnych mózgu. Mutacje blisko końca 5' regionu kodującego POMGnT1 prowadzą do stosunkowo cięższego fenotypu, takiego jak wodogłowie. Mutacje, które wystąpiły blisko końca 3', wykazują słabsze objawy.
MEB jest autosomalną recesywną chorobą dziedziczną po rodzicach. Pacjenci z MEB mają dwie kopie patogennego wariantu w swoim genie. Istnieje ryzyko urodzenia dziecka z MEB, biorąc pod uwagę, że oboje rodzice są nosicielami patogennego wariantu w swoim genie. Dotknięte chorobą dziecko dziedziczy zmutowaną kopię genu od każdego rodzica będącego nosicielem. Szansa na dziedziczenie wynosi 1 do 4, gdy oboje rodzice są nosicielami patogennego wariantu.
Patofizjologia
Patogeneza MEB związana jest z nieprawidłowym poziomem glikozylacji α-dystroglikanu. Mutacje genetyczne genu POMGnT1 zmniejszyły glikozylację O-mannozylu α-dystroglikanu. Gen POMGnT1 koduje enzym POMGnT1, białko transbłonowe typu II rezydujące w aparacie Golgiego. Rolą enzymu POMGnT1 jest katalizowanie glikozylacji swoistej dla końcowej alfa-połączonej mannozy, procesu, w którym N -acetyloglukozamina jest dodawana do O-połączonej mannozy α-dystroglikanu. U ludzi O-mannozylacja jest rzadkim rodzajem glikozylacji, występującym w glikoproteinach mięśni szkieletowych, mózgu i nerwów. O-mannozylacja jest stosowana w celu zwiększenia stabilności interakcji między zewnątrzkomórkową błoną podstawną a α-dystroglikanem. Bez stabilizacji glikoproteina nie może zakotwiczyć się w komórce, co prowadzi do wrodzonej dystrofii mięśniowej (CMD), charakteryzującej się poważnymi wadami rozwojowymi mózgu.
Diagnoza
Diagnostyka medyczna MEB zwykle obejmuje badanie wywiadu rodzinnego, pomiar poziomu CPK w surowicy, badania molekularne, biopsję mięśnia i badanie obrazowe.
Badanie lekarskie
Osoby z MEB mają charakterystyczne dysmorfizmy twarzy. Zaokrąglone czoło, cienka i opadająca warga, mikrognacja, cofnięcie środkowej części twarzy, krótki grzbiet nosa są możliwymi przesłankami rozpoznania. Ocena rozwoju motorycznego i umysłowego, zdolności wzrokowe również dostarczają wskazówek.
Test genetyczny
Test genetyczny może analizować genom niemowląt w celu potwierdzenia określonej mutacji genetycznej. Mutacja w POMGNT1 jest wyznacznikiem w diagnozie MEB. Kilka mutacji, takich jak [c.1539+1G→A], [c.879+5G→T], to dominująca zmiana nukleotydowa występująca u osób dotkniętych chorobą. Powszechnie stosowane praktyki polegają na gromadzeniu DNA płodu poprzez pobieranie próbek z przewlekłych kosmków, a następnie analizę powiązań i bezpośrednie sekwencjonowanie w celu ustalenia sekwencji genu POMGNT1.
Oznaczanie genomu pomaga odróżnić inne wrodzone dystrofie mięśniowe przed i po urodzeniu. Jednak tylko niektóre laboratoria zapewniają prenatalne testy genetyczne w celu wykrycia MEB.
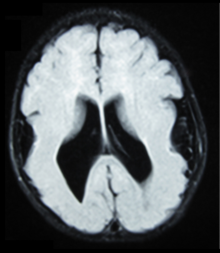
Obrazowanie medyczne
MEB można zdiagnozować za pomocą obrazowania medycznego na podstawie wspólnych wzorców nieprawidłowości strukturalnych mózgu. Powszechna praktyka obejmuje obrazowanie metodą rezonansu magnetycznego (MRI) i tomografię komputerową (CT). Mogą wykazywać powiększenie komory, brak lub zwyrodnienie przegrody przezroczystej, objawy pachygyryczne, nieprawidłowości w ciele kolosalnym, lissencephaly. MRI płodu i USG są wykorzystywane jako prenatalne narzędzie diagnostyczne, jeśli jest to konieczne do badania przesiewowego w kierunku choroby. Obserwacja, taka jak ogólna wada strukturalna w trzecim trymestrze, sugeruje wrodzoną dystrofię mięśniową. W celu potwierdzenia wymagane są dalsze testy diagnostyczne.
Klinicznie MRI jest preferowany w stosunku do tomografii komputerowej ze względu na jego zdolność do dokładniejszego ujawnienia migracji neuronów. Wynik uzyskany z tomografii komputerowej ogranicza się do wielkości komór i lokalizacji istoty białej, podczas gdy tylko MRI może dostarczyć informacji o problemach korowych.
Biopsja mięśnia
Biopsja mięśnia jest sposobem na zbadanie tkanki mięśniowej. Morfologia komórek mięśniowych i inne parametry chemiczne mogą być wykorzystane do diagnozowania choroby mięśniowo-oczo-brianowej. Zastosowanie biopsji obejmuje:
Analiza histologiczna
Bezpośrednie badanie tkanek mięśniowych może wykazać dystrofię mięśniową, co może wesprzeć potencjalną diagnozę MEB. Stwierdzono, że pacjenci mają okrągłe miofibryle o wyraźnie różnych średnicach, późniejsze jądra, włókna regenerujące i włókna kątowe w wyniku atrofii.
Test enzymatyczny
Mutacja MEB obejmuje nieprawidłowe działanie O -mannozylo-ß-1,2- N -acetylogukozaminylotransferazy 1. Mierząc aktywność enzymatyczną tego białka, można potwierdzić obecność MEB. Jako testowanych uczestników wybiera się fibroblasty i limfoblasty.
Immunochemia
Western-blot (immunoblot) może być użyty do wykrycia O -mannozylo-ß-1,2- N -acetylogukozaminylotransferazy 1 w celach diagnostycznych. Pomaga ocenić stan glikozylacji białka, które ma robić.
trudności
Jako podtyp dystrofii mięśniowej-dystroglikanopatii, MEB jest często mylony z innym podtypem, w tym zespołem Walkera-Warburga i wrodzoną dystrofią mięśniową Fukuyamy . Wszystkie te 3 choroby mają podobny obraz kliniczny i są klasyfikowane jako typ A (ciężki). Nakładające się wyniki zawierają obraz kliniczny i wynik immunochemii. Diagnoza musi dokonać rozróżnienia między nimi. Decydującymi dowodami przemawiającymi za MEB są:
| MEB | WWS | FCMD | |
| Epidemiologia | Finlandia | Na całym świecie | Japonia |
| Charakterystyczny wynik badania fizykalnego | |||
| Zaburzenia oka | Postępująca krótkowzroczność ze zwyrodnieniem siatkówki | Ciężkie wady rozwojowe | Prosta krótkowzroczność i zaćma bez zmian strukturalnych |
| Typowa lokalizacja przykurczów | Łokieć i kolano | Łokieć | Łokcie, kolana, kostki i biodra |
| Charakterystyczny wynik testu genetycznego | |||
| Główny współautor wadliwego genu | POMGNT1 | POMT1, POMT2 | FKTN |
| Niewielki wadliwy gen, który przyczynił się do jego powstania | FKRP, FKTN | FKRP, FCMD, LARGE, ISPD | -- |
| Charakterystyczny wynik MRI | |||
| Kora mózgowa | Rozproszona dysplazja | Rozproszony brukowiec lissencephaly | Polimikrogyria czołowa |
| Biała materia | Nierówne wydłużenie T1 i T2 | Brak mieliny w mózgu lub móżdżku | Opóźniona mielinizacja mózgu |
| Inni | |||
| Poziom kinazy kreatynowej w surowicy | Normalny do podwyższonego | Podniesiony do wysokiego poziomu | Podniesiony |
MEB: choroba mięśni-oko-mózg
WWS: zespół Walkera-Warburga
FCMD: wrodzona dystrofia mięśniowa Fukuyamy
Kierownictwo
Obecnie nie ma skutecznego leczenia żadnej postaci dystrofii mięśniowych, a pacjentom dostępna jest jedynie opieka objawowa.
Opieka wspomagająca odpowiadająca objawom to:
| Objaw | Odpowiednie leczenie wspomagające |
| przykurcze | Fizjologiczna terapia i operacja rozluźnienia ścięgien w razie potrzeby |
| Skolioza | Usztywnianie, szynowanie i operacje korekcyjne, takie jak stabilizacja kręgosłupa |
| Słabe mięśnie | Ortezy nóg, wózek inwalidzki, terapia zajęciowa |
| Problem z oddychaniem | Regularne monitorowanie za pomocą spirometrii, nieinwazyjnej wentylacji nocnej, tracheostomii, technik wspomagania kaszlu |
| Trudności w uczeniu się | Specjalistyczne programy edukacyjne |
| drgawki | Leki przeciwpadaczkowe [ potrzebne lepsze źródło ] |
| Problemy ze wzrokiem | Noś specjalne okulary |
| Opieka żywieniowa | Sondy nosowo-żołądkowe do krótkotrwałego użytku, gastrostomia do przewlekłych potrzeb |
Rokowanie
MEB to łagodniejszy typ wrodzonej dystrofii mięśniowej, z możliwością przeżycia do ponad 70 lat. Ciężkość MEB determinuje rokowanie. Chociaż rokowanie jest związane z postępem objawów, opieka podtrzymująca poprawia jakość życia, a także długość życia.
Epidemiologia
Większość przypadków MEB odnotowuje się w populacji fińskiej. Szacuje się, że dotyka 1 na 50 000 noworodków w Finlandii. MEB jest również identyfikowany poza Finlandią, odnotowano przypadki podejrzenia MEB w Japonii i Korei. Jednak światowa dystrybucja jest niejasna. Według Unii Europejskiej szacowana częstość występowania MEB w Europie wynosi 0,12 na 100 000. [41]
| Stawki przewoźnika | ||
| Pochodzenie etniczne | Szybkość wykrywania | Częstotliwość nośna |
| fiński | >99% | 1 na 50 |
| Ogólna populacja | 88% | 1 na 500 |
Częstotliwość bycia nosicielem MEB wynosi 1 na 50 w Finlandii, nosiciele MEB zwykle nie wykazują żadnych oznak ani symptomów. Jednak ich potomstwo będzie miało większe szanse na wpływ MEB.
Historia
MEB został po raz pierwszy odkryty w Finlandii. W 1978 roku pacjent z Finlandii wykazywał objawy, takie jak wrodzone osłabienie mięśni, ciężka krótkowzroczność, jaskra, wady wzroku, niepełnosprawność intelektualna, niedorozwój siatkówki itp. W 1980 roku w Finlandii zidentyfikowano 14 kolejnych osób z podobnymi objawami. Podobne przypadki opublikowano również w 1989 roku. Chorobę stwierdzono w Holandii w 1992 roku, zachorowało 6 osób pochodzących z 4 rodzin. Następnie zgłoszono więcej przypadków poza populacją fińską.
MEB jest fenotypowo podobny do zespołu Walkera-Warburga (WWS), oba zaburzenia to wrodzona dystrofia mięśniowa. W 1990 roku Santavuori argumentował za odróżnieniem MEB od WWS, ponieważ MEB dotyczy w szczególności osłabienia mięśni, a pacjenci z MEB mają stosunkowo długie przeżycie. W tym samym roku Dobyns zbadał dalej związek WWS i MEB.
W 2001 roku po raz pierwszy wykazano przyczynę MEB jako mutacje w genie POMGNT1 powodujące utratę jego funkcji.
- ^ „Choroba mięśni oka i mózgu | Centrum informacji o chorobach genetycznych i rzadkich (GARD) - program NCATS” . rzadkie choroby.info.nih.gov . Źródło 27 października 2019 r .
- ^ a b c d e f g h i j k l m n „Choroba mięśni oka i mózgu | Centrum informacji o chorobach genetycznych i rzadkich (GARD) - program NCATS” . rzadkie choroby.info.nih.gov . Źródło 2019-03-27 .
- ^ ab Fahnehjelm , Kristina Teär; Ygge, Jan; Engman, Mona-Lisa; Mosskin, Mikael; Santavuori, Pirkko; Malm, Gunilla (2001). „Dziecko z chorobą mięśni-oczu-mózgu” . Acta Ophthalmologica Scandinavica . 79 (1): 72–75. doi : 10.1034/j.1600-0420.2001.079001072.x . ISSN 1600-0420 . PMID 11167293 .
- ^ a b c Haltia, M .; Leivo, I.; Somer, H.; Pihko, H.; Paetau, A.; Kivelä, T.; Tarkkanen, A.; Tomé, F.; Engvall, E. (1997). „Mięśnie - oko - choroba mózgu: badanie neuropatologiczne”. Roczniki neurologii . 41 (2): 173–180. doi : 10.1002/ana.410410208 . ISSN 1531-8249 . PMID 9029066 . S2CID 32029963 .
- ^ Shenoy, Anant M; Markowitz, Jennifer A; Bonnemann, Carsten G; Krishnamoorthy, Kalpatia; Bossler, Aaron D; Tseng, Brian S (marzec 2010). „Choroba mięśni – oczu – mózgu” . Journal of Clinical Neuromuscular Disease . 11 (3): 124–126. doi : 10.1097/CND.0b013e3181c5054d . ISSN 1522-0443 . PMC 2925645 . PMID 20215985 .
- ^ a b c d Diesen, C (2004-10-01). „Mutacja POMGnT1 i spektrum fenotypowe w chorobie mięśni-oko-mózg” . Dziennik genetyki medycznej . 41 (10): e115. doi : 10.1136/jmg.2004.020701 . ISSN 1468-6244 . PMC 1735594 . PMID 15466003 .
- ^ a b c Pihko, Helena; Lappi, Marjatta; Raitta, Krystyna; Sainio, Kimmo; Valanne, Leena; Somer, Hannu; Santavuori, Pirkko (styczeń 1995). „Wyniki oka w chorobie mięśni-oko-mózgu (MEB): badanie kontrolne”. Mózg i rozwój . 17 (1): 57–61. doi : 10.1016/0387-7604(94)00101-3 . ISSN 0387-7604 . PMID 7762765 . S2CID 33926340 .
- ^ a b c d Falsaperla, Raffaele; Praticò, Andrea D.; Ruggieri, Martino; Parano, Enrico; Rizzo, Renata; Corsello, Giovanni; Vitaliti, Giovanna; Pavone, Piero (2016-08-31). „Wrodzona dystrofia mięśniowa: od mięśni do mózgu” . Włoski Dziennik Pediatrii . 42 (1): 78. doi : 10.1186/s13052-016-0289-9 . ISSN 1824-7288 . PMC 5006267 . PMID 27576556 .
- ^ „O52 Wzrokowe potencjały wywołane i elektroretinografia u pacjentów ze śmiercią mózgu” . Neurophysiologie Clinique/Neurofizjologia kliniczna . 20 :18s. sierpień 1990. doi : 10.1016/s0987-7053(05)80490-3 . ISSN 0987-7053 . S2CID 53160311 .
- ^ a b c d e f g h Taniguchi, K. (2003-03-01). „Ogólnoświatowa dystrybucja i szersze spektrum kliniczne choroby mięśni, oczu i mózgu” . Genetyka molekularna człowieka . 12 (5): 527–534. doi : 10.1093/hmg/ddg043 . ISSN 1460-2083 . PMID 12588800 .
- ^ Shenoy, Anant M; Markowitz, Jennifer A; Bonnemann, Carsten G; Krishnamoorthy, Kalpatia; Bossler, Aaron D; Tseng, Brian S (marzec 2010). „Choroba mięśni – oczu – mózgu” . Journal of Clinical Neuromuscular Disease . 11 (3): 124–126. doi : 10.1097/CND.0b013e3181c5054d . ISSN 1522-0443 . PMC 2925645 . PMID 20215985 .
- ^ a b Raducu, Madalina; Cotarelo, Rocio P.; Simon, Rogelio; Camacho, Ana; Rubio-Fernández, Marcos; Hernández-Laín, Aurelio; Cruces, Jesús (luty 2014). „Cechy kliniczne i charakterystyka molekularna pacjenta z chorobą mięśni – oczu – mózgu: nowa mutacja w genie POMGNT1”. Dziennik Neurologii Dziecięcej . 29 (2): 289–294. doi : 10.1177/0883073813509119 . hdl : 10261/124385 . ISSN 0883-0738 . PMID 24282183 . S2CID 9209393 .
- Bibliografia _ Leisti, J.; Kruus, S. (1977). „Choroba mięśni, oczu i mózgu: nowy syndrom”. Neuropediatria . 8 (S 01): 553. doi : 10.1055/s-0028-1091594 . ISSN 0174-304X .
- ^ a b c Referencje, strona główna genetyki. „Gen POMGNT1” . Strona główna genetyki . Źródło 2019-03-27 .
-
^ a b c d
„Choroba mięśni oka i mózgu - gen: POMGNT1” . GeneAware . Źródło 30 kwietnia 2020 r .
{{ cite web }}: CS1 maint: stan adresu URL ( link ) - Bibliografia _ Lommel, Mark (2009-08-01). „O-mannozylacja białka: zachowana od bakterii do ludzi” . glikobiologia . 19 (8): 816–828. doi : 10.1093/glikob/cwp066 . ISSN 0959-6658 . PMID 19429925 .
- ^ a b c d e f g h S, Gosal Gurinder; H, Shah Hitesh (marzec 2011). „Choroba mięśni-oko-mózg; rzadka postać syndromicznej wrodzonej dystrofii mięśniowej” . Malezyjski Dziennik Ortopedyczny . 5 (1): 67–70. doi : 10.5704/moj.1103.016 . ISSN 1985-2533 .
- ^ a b c A, Diesen, C Saarinen, A Pihko, H Rosenlew, C Cormand, B Dobyns, W Dieguez, J Valanne, L Joensuu, T Lehesjoki (październik 2004). „Mutacja POMGnT1 i spektrum fenotypowe w chorobie mięśni-oko-mózg” . Dziennik genetyki medycznej . Grupa BMJ. 41 (10): e115. doi : 10.1136/jmg.2004.020701 . OCLC 679802406 . PMC 1735594 . PMID 15466003 .
- ^ a b Saredi, S .; Ardissone, A.; Ruggieri, A.; Mottarelli, E.; Farina L.; Rinaldi, R.; Silvestri, E.; Gandioli, C.; D'Arrigo, S. (lipiec 2012). „Nowe mutacje punktowe POMGNT1 i rearanżacje wewnątrzgenowe związane z chorobą mięsień-oko-mózg” . Dziennik Nauk Neurologicznych . 318 (1–2): 45–50. doi : 10.1016/j.jns.2012.04.008 . ISSN 0022-510X . PMC 3405532 . PMID 22554691 .
- ^ Balci, Burcu; Morris-Rosendahl, Deborah J.; Çelebi, Asli; Talim, Beril; Topalo??lu, Haluk; Kolacja, Pervin (2006). „Diagnostyka prenatalna choroby mięśni-oko-mózgu”. Diagnostyka prenatalna . 27 (1): 51–54. doi : 10.1002/pd.1622 . ISSN 0197-3851 . PMID 17154333 . S2CID 44662331 .
- ^ a b Valanne, L .; Pihko, H.; Katevuo, K.; Karttunen, P.; Somer, H.; Santavuori, P. (sierpień 1994). „MRI mózgu w chorobie mięsień-oko-mózg (MEB)”. Neuroradiologia . 36 (6): 473–476. doi : 10.1007/BF00593687 . ISSN 0028-3940 . PMID 7991095 . S2CID 19829870 .
- Bibliografia _ Nguyen, T.; Ryan, ja (2010-05-31). „Nauczanie NeuroImages: Prenatal MRI choroby mięśni-oko-mózg” . Neurologia . 74 (22): e101. doi : 10.1212/wnl.0b013e3181e0f84b . ISSN 0028-3878 . PMID 20513809 .
- ^ a b Raducu, Madalina; Cotarelo, Rocio P.; Simon, Rogelio; Camacho, Ana; Rubio-Fernández, Marcos; Hernández-Laín, Aurelio; Cruces, Jesús (2013-11-25). „Cechy kliniczne i charakterystyka molekularna pacjenta z chorobą mięśni – oczu – mózgu” (PDF) . Dziennik Neurologii Dziecięcej . 29 (2): 289–294. doi : 10.1177/0883073813509119 . hdl : 10261/124385 . ISSN 0883-0738 . PMID 24282183 . S2CID 9209393 .
- Bibliografia _ Zhang, Wenli; Dobyns, William B.; Biggar, Doug; Holden, Kenton R.; Hawkins, Cynthia; Ray, Piotr; Olney, Ann H.; Burson, Katarzyna M. (luty 2006). „Nosiciele i pacjenci z chorobą mięśni, oczu i mózgu można szybko zdiagnozować za pomocą analizy enzymatycznej fibroblastów i limfoblastów”. Zaburzenia nerwowo-mięśniowe . 16 (2): 132–136. doi : 10.1016/j.nmd.2005.11.012 . ISSN 0960-8966 . PMID 16427280 . S2CID 21928381 .
- ^ Geis, Tobiasz; Marquard, Klaus; Rödl, Tanja; Reihle, Christof; Schirmer, Zofia; von Kalle, Thekla; Bornemann, Antje; Hehr, Ute; Blankenburg, Markus (20.09.2013). „Homozygotyczna mutacja dystroglikanu związana z nowym fenotypem podobnym do choroby mięśni, oczu i mózgu z leukodystrofią wielotorbielowatą”. Neurogenetyka . 14 (3-4): 205-213. doi : 10.1007/s10048-013-0374-9 . ISSN 1364-6745 . PMID 24052401 . S2CID 15027740 .
- ^ ab Amberger , Joanna; Bocchini, Carol; Hamosz, Ada (2011-04-05). „Nowa twarz i nowe wyzwania dla internetowego dziedziczenia mendlowskiego u człowieka (OMIM®)” . Ludzka mutacja . 32 (5): 564–567. doi : 10.1002/humu.21466 . ISSN 1059-7794 . PMID 21472891 .
- ^ Bertini, Enrico; D'Amico, Adele; Gualandi, Francesca; Petrini, Stefania (grudzień 2011). „Wrodzona dystrofia mięśniowa: krótki przegląd” . Seminaria z neurologii dziecięcej . 18 (4): 277–288. doi : 10.1016/j.spen.2011.10.010 . PMC 3332154 . PMID 22172424 .
- Bibliografia _ Avela, Krystyna; Pihko, Helena; Santavuori, Pirkko; Talim, Beril; Topaloglu, Haluk; de la Chapelle, Albert; Lehesjoki, Anna-Elina (styczeń 1999). „Przypisanie genu choroby mięśni – oczu – mózgu do 1p32-p34 przez analizę powiązań i mapowanie homozygotyczności” . American Journal of Human Genetics . 64 (1): 126–135. doi : 10.1086/302206 . ISSN 0002-9297 . PMC 1377710 . PMID 9915951 .
- ^ a b Wang, Ching H.; Bonnemann, Carsten G.; Rutkowski, Anna; Sejersen, Thomas; Bellini, Jonathan; Battista, Vanessa; Florencja, Julaine M.; Schara, Ulrike; Schuler, Pamela M. (grudzień 2010). „Oświadczenie zgodne w sprawie standardu opieki nad wrodzonymi dystrofiami mięśniowymi” . Dziennik Neurologii Dziecięcej . 25 (12): 1559-1581. doi : 10.1177/0883073810381924 . ISSN 0883-0738 . PMC 5207780 . PMID 21078917 .
- Bibliografia _ Morrison, L.; Iannaccone, ST; Graham, RJ; Bonnemann, CG; Rutkowski, A.; Hornyak, J.; Wang, CH; Północ, K. (2015-03-31). „Oparte na dowodach podsumowanie wytycznych: ocena, diagnoza i leczenie wrodzonej dystrofii mięśniowej: raport Podkomitetu ds. Rozwoju Wytycznych Amerykańskiej Akademii Neurologii oraz Panelu Przeglądu Zagadnień Praktyki Amerykańskiego Stowarzyszenia Medycyny Nerwowo-mięśniowej i Elektrodiagnostycznej” . Neurologia . 84 (13): 1369-1378. doi : 10.1212/WNL.0000000000001416 . ISSN 0028-3878 . PMC 4388744 . PMID 25825463 .
- ^ Iskry, Susan E.; Quijano-Roy, Susana; Harper, Amy; Rutkowski, Anna; Gordon, Erynn; Hoffman, Eric P.; Pegoraro, Elena (1993). „Przegląd wrodzonej dystrofii mięśniowej - ROZDZIAŁ ARCHIWALNY, WYŁĄCZNIE DO CELÓW HISTORYCZNYCH” . W Adamie Małgorzata P.; Ardinger, Holly H.; Pagon, Roberta A.; Wallace, Stephanie E. (red.). Przegląd wrodzonej dystrofii mięśniowej . GeneReviews® . Uniwersytet Waszyngtoński w Seattle. PMID 20301468 . Źródło 2019-03-27 .
- ^ ab Barkovich , AJ (wrzesień 1998). „Przejawy neuroobrazowania i klasyfikacja wrodzonych dystrofii mięśniowych” . AJNR. American Journal of Neuroradiology . 19 (8): 1389-1396. ISSN 0195-6108 . PMC 8338698 . PMID 9763366 .
- ^ ab , Kirschner, Janbernd (2013), „Wrodzona dystrofia mięśniowa” , Neurologia dziecięca, część III Podręcznik neurologii klinicznej, tom. 113, Elsevier, s. 1377–1385, doi : 10.1016/b978-0-444-59565-2.00008-3 , ISBN 9780444595652 , PMID 23622361 , pobrane 2019-03-27
- ^ abc Horrocks , I .; Muntoni, F.; Longman, C.; Józef, S. (2014-10-01). „GP315: Przypadki normalnej lub nieznacznie podwyższonej kinazy kreatynowej u pacjentów z chorobą mięśni, oczu i mózgu oraz opóźnienia w diagnozie” . Zaburzenia nerwowo-mięśniowe . 24 (9): 916. doi : 10.1016/j.nmd.2014.06.405 . ISSN 0960-8966 . S2CID 53300651 .
-
^ a b
Myriad Women's Health https://myriadwomenshealth.com/2014/05/hello-world/ . Źródło 2019-03-27 .
{{ cite web }}: Brak lub pusty|title=( pomoc ) - Bibliografia _ LAMMINEN, MAIJA; SANTAVUORI, PIRKKO; LEISTI, JAAKKO (2009-05-27). „Wyniki okulistyczne w nowym zespole z udziałem mięśni, oczu i mózgu”. Acta Ophthalmologica . 56 (3): 465–472. doi : 10.1111/j.1755-3768.1978.tb05700.x . ISSN 1755-375X . PMID 581135 . S2CID 28078013 .
- ^ W., Eriksson, Aldur (1980). Struktura populacji i zaburzenia genetyczne: Mariehamm, Wyspy Alandzkie, Finlandia, sierpień 1978 r . Akademicki Pr. ISBN 0122414500 . OCLC 313921203 .
- Bibliografia _ Somer, H.; Sainio, K.; Rapola, J.; Kruus S.; Nikitin, T.; Ketonen, L.; Leisti, J. (1989). „Choroba mięśni-oko-mózg (MEB)”. Mózg i rozwój . 11 (3): 147–153. doi : 10.1016/S0387-7604(89)80088-9 . ISSN 0387-7604 . PMID 2751061 . S2CID 4702708 .
- Bibliografia _ Gabreëls, FJ; Renier, WO; Renkawek, K.; ter Laak, HJ; Mullaart, RA (grudzień 1992). „Wrodzona dystrofia mięśniowa z wadami rozwojowymi oka i mózgu u sześciu holenderskich pacjentów”. Neuropediatria . 23 (6): 316–320. doi : 10.1055/s-2008-1071365 . ISSN 0174-304X . PMID 1491751 .
- Bibliografia _ Pihko, H.; Sainio, K.; Lappi, M.; Somer, H.; Haltia, M.; Raitta, C.; Ketonen, L.; Leisti, J. (lipiec 1990). „Choroba mięśni-oko-mózg i zespół Walkera-Warburga”. American Journal of Medical Genetics . 36 (3): 371–374. doi : 10.1002/ajmg.1320360334 . ISSN 0148-7299 . PMID 2363444 .
- ^ Dobyns, William B.; Pagon, Roberta A.; Curry, Cynthia JR; Greenberg, Frank (lipiec 1990). „Odpowiedź na Santavuori i wsp. Dotycząca zespołu Walkera-Warburga i choroby mięśni-oko-mózgu”. American Journal of Medical Genetics . 36 (3): 373–374. doi : 10.1002/ajmg.1320360335 . ISSN 0148-7299 .
- Bibliografia _ Kobayashi, K.; Manya, H.; Taniguchi, K.; Kano, H.; Mizuno, M.; Inazu, T.; Mitsuhashi, H.; Takahashi, S. (listopad 2001). „Dystrofia mięśniowa i zaburzenie migracji neuronów spowodowane mutacjami w glikozylotransferazie, POMGnT1” . Komórka rozwojowa . 1 (5): 717–724. doi : 10.1016/S1534-5807(01)00070-3 . ISSN 1534-5807 . PMID 11709191 .