Dehydrogenaza tiosiarczanowa
| Dehydrogenaza tiosiarczanowa | |||||||||
|---|---|---|---|---|---|---|---|---|---|
 Struktura 3D dehydrogenazy tiosiarczanowej z substratem tiosiarczanowym obecnym w miejscu aktywnym, odpowiadająca kodowi RCSB 4V2K
| |||||||||
| Identyfikatory | |||||||||
| nr WE | 1.8.2.2 | ||||||||
| nr CAS | 9076-88-4 | ||||||||
| Bazy danych | |||||||||
| IntEnz | Widok IntEnz | ||||||||
| BRENDA | Wpis BRENDY | ||||||||
| ExPASy | Widok NiceZyme | ||||||||
| KEGG | Wpis KEGG | ||||||||
| MetaCyc | szlak metaboliczny | ||||||||
| PRYM | profil | ||||||||
| Struktury PDB | RCSB PDB PDBe PDB suma | ||||||||
| Ontologia genów | AmiGO / QuickGO | ||||||||
| |||||||||
Dehydrogenaza tiosiarczanowa (w skrócie TsdA) ( EC 1.8.2.2 ) jest enzymem , który katalizuje reakcję chemiczną :
- 2 tiosiarczan + 2 żelazocytochrom do tetrationian + 2 żelazocytochrom c
Zatem dwoma substratami tego enzymu są tiosiarczan i ferrycytochrom c, podczas gdy jego dwoma produktami są tetrationian i ferrocytochrom c.
Homologi dehydrogenazy tiosiarczanowej zostały wyizolowane z wielu gatunków bakterii i różnią się nieznacznie budową, ale mają analogiczną funkcję i mechanizm utleniania siarki. Enzym jest podobny zarówno pod względem funkcji, jak i struktury do kilku enzymów na szlaku utleniania siarki Soxa.
Nomenklatura
Enzym ten należy do rodziny oksydoreduktaz , w szczególności działających na donorową grupę siarkową z cytochromem jako akceptorem. Systematyczna nazwa tej klasy enzymów to tiosiarczan: oksydoreduktaza ferrycytochromu-c. Inne powszechnie stosowane nazwy obejmują syntazę tetrationianową, oksydazę tiosiarczanową, enzym utleniający tiosiarczan i oksydoreduktazę akceptującą tiosiarczan.
Struktura
Dehydrogenaza tiosiarczanowa, wyizolowana z dobrze przebadanego szczepu bakteryjnego Allochromatium vinosum (długość łańcucha peptydowego 253, 25,8 kDa) składa się z dwóch domen katalitycznych, z których każda jest podobna do cytochromu c , połączonych długim nieustrukturyzowanym łańcuchem peptydowym. Domena N-końcowa jest strukturalnie homologiczna do rodziny enzymów cytochromowych SoxA, podczas gdy domena C-końcowa jest reprezentatywna dla standardowego mitochondrialnego fałdu rodziny cytochromu c z dużym podobieństwem do reduktazy azotynowej z P. haloplanktis . Każda domena zawiera kowalencyjnie związaną cząsteczkę hemu zawierającą żelazo, oddzieloną niewielką odległością 8,1 Å, która pomaga w szybkim przenoszeniu elektronów. Zarówno domeny N, jak i C-końcowe zawierają 4 helisy α (otaczające hem w odpowiedniej domenie) i dwuniciowy antyrównoległy arkusz β, co sugeruje, że enzym powstał w wyniku zdarzenia duplikacji genu.
Pojedyncze miejsce aktywne enzymu znajduje się pomiędzy dwiema domenami (bliżej domeny C-końcowej) w pobliżu centralnego hemu żelaza.
Mechanizm
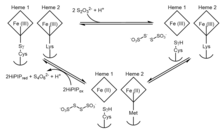
Istnieją kontrowersje co do dokładnego mechanizmu, za pomocą którego enzym umożliwia zajście, więc proces pozostaje niejednoznaczny. Ponadto różnorodność enzymów dehydrogenazy tiosiarczanowej wśród gatunków bakterii implikuje kilka możliwych mechanizmów działania. Jednak ze względu na uderzające podobieństwo w strukturze domen dehydrogenazy tiosiarczanowej do białka nośnikowego siarki SoxYZ i cytochromu SoxAX, można wyprowadzić pokrewny mechanizm reakcji katalizowanej dehydrogenazą tiosiarczanową u A. vinosum . Ogólny, uogólniony przegląd proponowanego mechanizmu dehydrogenazy tiosiarczanowej można podsumować za pomocą następujących dwóch odwracalnych reakcji redoks:
Etap 1 wskazuje na początkowe wiązanie tiosiarczanu z niezwykłym i reaktywnym adduktem S -sulfanowym cysteiny, tworząc addukt S -tiosulfonianowy. Etap 2 następuje z dodatkowym tiosiarczanem, aby następnie utworzyć tetrationian, jednocześnie redukując oba hemy i pozostawiając typową resztę cysteiny. W miejscu aktywnym reszta cysteiny związana z katalitycznym hemem żelaza jest niezbędna do aktywności enzymatycznej, ponieważ zniesienie tej reszty całkowicie wyeliminowało zdolność enzymu zarówno do utleniania tiosiarczanu, jak i redukcji tetrationianu. W A. vinosum , chociaż proces jest odwracalny, reakcja tworzenia dwóch jonów tiosiarczanowych jest znacznie wolniejsza niż tworzenie tetrationianu, pomimo redukcji tetrationianu do tiosiarczanu o potencjale +198 mV.
Redukcja enzymu powoduje zmianę ligandu z Lys208 na Met209 w drugim hemie. Zmutowane białka, które zastępują Met209 asparaginą lub glicyną, mają podobne powinowactwo do substratów jak wariant typu dzikiego, ale mają znacznie niższą aktywność właściwą, co sugeruje, że hem 2 jest punktem wyjścia elektronów na ostatnich etapach mechanizmu. Po redukcji hemu 2 i przełączeniu ligandu potencjał redoks wzrasta i hamuje reakcję wsteczną z utworzeniem tiosiarczanu. Tutaj sugeruje się, że białko żelazowo-siarkowe o wysokim potencjale (HiPIP) służy jako akceptor elektronów w utlenianiu obu hemów do ich stanu początkowego.
Funkcjonować
Utlenianie tiosiarczanu do tetrationianu obserwuje się u kilku tiobacilli, fototrofów i heterotrofów, ponieważ tiosiarczan i tetrationian odgrywają odpowiednio rolę donora elektronów i akceptora elektronów u wielu gatunków bakterii. Oba związki są półproduktami i odgrywają ważną rolę w biogeochemicznym cyklu siarki, procesie konwersji między siarczkiem a siarczanem. Zatem dehydrogenaza tiosiarczanowa jest niezbędna do konwersji między półproduktami w cyklu siarki. Cykl siarki umożliwia różnym bakteriom wykorzystanie wytworzonego tiosiarczanu jako donora elektronów do wzrostu tlenowego i beztlenowego wiązania dwutlenku węgla do fotosyntezy. Pseudomonas i Halomonas to przykłady wielu tiobakterii, które wykorzystują dehydrogenazę tiosiarczanową do pozyskiwania energii z tiosiarczanu jako dodatkowego źródła energii. Tetrationian może służyć jako oddechowy akceptor elektronów podczas oddychania beztlenowego poprzez redukcję tetrationianu.
Zastosowania przemysłowe
Tiobakterie, takie jak Acidithiobacillus ferrooxidans , stały się niezbędne w przemysłowych zastosowaniach bioługowania, ponieważ mikroorganizmy są w stanie utleniać żelazo i siarkę z minerałów żelazowo-siarkowych jako źródła energii, wspierając własny wzrost autotroficzny, jednocześnie wytwarzając żelazo żelazowe i kwas siarkowy. W ten sposób bakterie wyizolowano ze złóż mineralnych i wykorzystano do obróbki ogniotrwałych rud złota i żelaza oraz do detoksykacji odpadów przemysłowych, ścieków i gleb zanieczyszczonych metalami ciężkimi.