Reduktaza glutationu
| GSR | |||||||||||||||||||||||||||||||||||||||||||||||
|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|
 | |||||||||||||||||||||||||||||||||||||||||||||||
| |||||||||||||||||||||||||||||||||||||||||||||||
| Identyfikatory | |||||||||||||||||||||||||||||||||||||||||||||||
| , HEL-75, HEL-S-122m, reduktaza glutationowa, reduktaza glutationowo-disiarczkowa, GR, GSRD | |||||||||||||||||||||||||||||||||||||||||||||||
| Identyfikatory zewnętrzne | |||||||||||||||||||||||||||||||||||||||||||||||
| |||||||||||||||||||||||||||||||||||||||||||||||
| |||||||||||||||||||||||||||||||||||||||||||||||
| |||||||||||||||||||||||||||||||||||||||||||||||
| |||||||||||||||||||||||||||||||||||||||||||||||
| |||||||||||||||||||||||||||||||||||||||||||||||
| Wikidane | |||||||||||||||||||||||||||||||||||||||||||||||
| |||||||||||||||||||||||||||||||||||||||||||||||
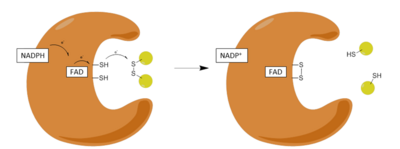
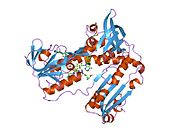
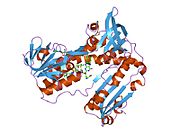
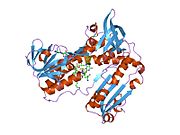
Reduktaza glutationowa ( GR ) znana również jako reduktaza glutationowo - dwusiarczkowa ( GSR ) jest enzymem kodowanym u ludzi przez gen GSR . Reduktaza glutationu (EC 1.8.1.7) katalizuje redukcję dwusiarczku glutationu ( GSSG ) do sulfhydrylowej formy glutationu ( GSH ), która jest cząsteczką o krytycznym znaczeniu dla odporności na stres oksydacyjny i utrzymywanie redukującego środowiska komórki. Reduktaza glutationu działa jako dimeryczna oksydoreduktaza disiarczkowa i wykorzystuje grupę prostetyczną FAD i NADPH do redukcji jednego równoważnika molowego GSSG do dwóch równoważników molowych GSH:
Reduktaza glutationu jest zachowana między wszystkimi królestwami . U bakterii , drożdży i zwierząt znaleziono jeden gen reduktazy glutationu; jednak w roślin kodowane są dwa geny GR. Drosophila i trypanosomy w ogóle nie mają GR. W tych organizmach redukcja glutationu jest przeprowadzana odpowiednio przez tioredoksyny lub trypanotionu .
Funkcjonować
| reduktaza glutationowo-disiarczkowa | |||||||||
|---|---|---|---|---|---|---|---|---|---|
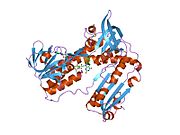
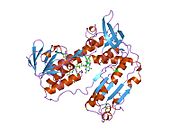
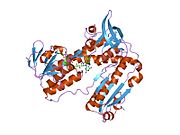
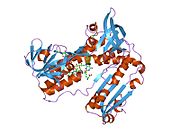
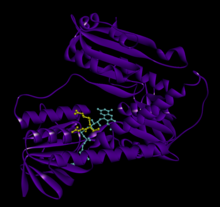 Ludzki GSR ze związanym glutationem i
| |||||||||
| identyfikatory FADH | |||||||||
| nr WE | 1.8.1.7 | ||||||||
| nr CAS | 9001-48-3 | ||||||||
| Bazy danych | |||||||||
| IntEnz | Widok IntEnz | ||||||||
| BRENDA | Wpis BRENDY | ||||||||
| ExPASy | Widok NiceZyme | ||||||||
| KEGG | Wpis KEGG | ||||||||
| MetaCyc | szlak metaboliczny | ||||||||
| PRYM | profil | ||||||||
| Struktury PDB | RCSB PDB PDBe PDB suma | ||||||||
| Ontologia genów | AmiGO / QuickGO | ||||||||
| |||||||||
Glutation odgrywa kluczową rolę w utrzymaniu prawidłowego funkcjonowania i zapobieganiu stresowi oksydacyjnemu w komórkach człowieka. Może działać jako wychwytywacz rodników hydroksylowych , tlenu singletowego i różnych elektrofilów . Zredukowany glutation redukuje utlenioną postać enzymu peroksydazy glutationowej , co z kolei redukuje nadtlenek wodoru (H 2 O 2 ), niebezpiecznie reaktywną substancję w komórce. [Na poniższej ilustracji reakcji redoks prawa strzałka jest odwrócona; powinien być skierowany w górę, a nie w dół.] Ponadto odgrywa kluczową rolę w metabolizmie i klirensie ksenobiotyki , działa jako kofaktor niektórych enzymów odtruwających, uczestniczy w transporcie i regeneracji przeciwutleniaczy, takich jak witaminy E i C, do ich reaktywnych form. Stosunek GSSG/GSH obecny w komórce jest kluczowym czynnikiem w prawidłowym utrzymaniu równowagi oksydacyjnej komórki, co oznacza, że niezwykle ważne jest, aby komórka utrzymywała wysoki poziom zredukowanego glutationu i niski poziom utlenionego dwusiarczku glutationu. Ta wąska równowaga jest utrzymywana przez reduktazę glutationową, która katalizuje redukcję GSSG do GSH.
Struktura
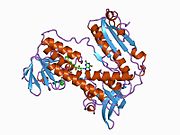
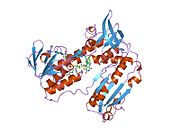
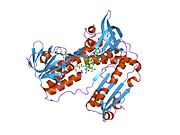
Reduktaza glutationowa z ludzkich erytrocytów jest homodimerem składającym się z monomerów 52Kd, z których każdy zawiera 3 domeny. GR wykazuje jednowarstwową, dwuwarstwową topologię, w której antyrównoległy arkusz beta jest w dużej mierze wystawiony na działanie rozpuszczalnika po jednej stronie, podczas gdy po drugiej stronie jest pokryty przypadkowymi cewkami. Obejmuje to domenę wiążącą NADPH , domenę (domeny) wiążącą FAD i domenę dimeryzacyjną. Każdy monomer zawiera 478 reszt i jedną cząsteczkę FAD. GR jest termostabilnym białkiem, zachowującym swoją funkcję do 65°C.
Mechanizm reakcji
Kroki:
| 1 | Wiązanie NADPH z utlenionym enzymem |
| 2 | Redukcja FAD do FADH − anionu przez NADPH |
| 3 | Zredukowany FADH - anion zapada się w kompleks przekaźnika ładunku i redukuje dwusiarczek Cys 58 -Cys 63 |
| 4 | Utleniony dwusiarczek glutationu wiąże się ze zredukowanym enzymem i tworzy mieszany dwusiarczek z Cys 58 i uwalnia jeden zredukowany glutation |
| 5 | Cys 63 atakuje mieszany dwusiarczek na Cys 58 , aby uwolnić zredukowany glutation i zreformować aktywny dwusiarczek redoks |
Połówka redukcyjna
Działanie GR przebiega przez dwie odrębne reakcje połówkowe, redukujący mechanizm półpołowy, po którym następuje połówka oksydacyjna. W pierwszej połowie NADPH redukuje FAD obecny w GSR do wytworzenia przejściowego anionu FADH - . Ten anion następnie szybko rozrywa wiązanie dwusiarczkowe Cys 58 - Cys 63 , tworząc krótkotrwałe wiązanie kowalencyjne, stabilny kompleks z przeniesieniem ładunku między flawiną a Cys 63 . Utleniony teraz NADP+ jest uwalniany, a następnie zastępowany przez nową cząsteczkę NADPH. Na tym kończy się tzw. redukcyjna połowa mechanizmu.
Połówka oksydacyjna
W oksydacyjnej połowie mechanizmu Cys 63 atakuje nukleofilowo najbliższą jednostkę siarczkową w cząsteczce GSSG (promowaną przez His 467 ), co tworzy mieszane wiązanie dwusiarczkowe (GS-Cys 58 ) i anion GS- . Jego 467 GSR następnie protonuje anion GS, aby uwolnić pierwszą cząsteczkę GSH. Następnie Cys 63 atakuje nukleofilowo siarczek Cys 58 , uwalniając anion GS- , który z kolei wychwytuje proton rozpuszczalnika i jest uwalniany z enzymu, tworząc w ten sposób drugi GSH. Tak więc, dla każdego GSSG i NADPH, uzyskuje się dwie zredukowane cząsteczki GSH , które mogą ponownie działać jako przeciwutleniacze wychwytujące reaktywne formy tlenu w komórce .
Zahamowanie
In vitro reduktaza glutationu jest hamowana przez niskie stężenia arseninu sodu i metabolity metylowanego arsenianu, ale in vivo znaczące hamowanie reduktazy glutationu przez arsenian sodu wynosi tylko 10 mg/kg/dobę. Reduktaza glutationowa jest również hamowana przez niektóre flawonoidy , klasę pigmentów wytwarzanych przez rośliny.
Znaczenie kliniczne
GSH jest kluczowym przeciwutleniaczem komórkowym i odgrywa główną rolę w klirensie metabolicznym fazy 2 elektrofilowych ksenobiotyków. Znaczenie szlaku GSH i enzymów wpływających na tę delikatną równowagę zyskuje w ostatnich latach coraz większą uwagę. Chociaż reduktaza glutationowa była atrakcyjnym celem dla wielu farmaceutyków, do tej pory nie stworzono skutecznych związków terapeutycznych związanych z reduktazą glutationową. W szczególności reduktaza glutationu wydaje się być dobrym celem dla leków przeciwmalarycznych, ponieważ reduktaza glutationu pasożyta malarii Plasmodium falciparum ma znacząco inny fałd białkowy niż reduktaza glutationu ssaków. Projektując leki specyficzne dla p. falciparum może być możliwe selektywne wywołanie stresu oksydacyjnego u pasożyta, bez wpływu na żywiciela.
Istnieją dwie główne klasy związków ukierunkowanych na GR:
- Inhibitory wiązania GSSG lub dimeryzacji: Reaktywne elektrofile , takie jak związki złota i fluoronaftochinony.
- Leki, które wykorzystują reduktazę glutationową do regeneracji, takie jak cyklery redoks. Dwa przykłady tego typu związków to błękit metylenowy i naftochinon .
Badania kliniczne przeprowadzone w Burkina Faso wykazały mieszane wyniki w leczeniu malarii za pomocą naftochinonów
W komórkach narażonych na wysoki poziom stresu oksydacyjnego , takich jak czerwone krwinki , do 10% zużycia glukozy może być kierowane do szlaku pentozofosforanowego (PPP) w celu produkcji NADPH potrzebnego do tej reakcji. W przypadku erytrocytów, jeśli PPP jest niefunkcjonalne, wówczas stres oksydacyjny w komórce doprowadzi do lizy komórki i anemii .
Toczeń jest zaburzeniem autoimmunologicznym, w którym pacjenci wytwarzają podwyższoną ilość przeciwciał, które atakują DNA i inne składniki komórkowe. W niedawnym badaniu stwierdzono, że polimorfizm pojedynczego nukleotydu (SNP) w genie reduktazy glutationu jest silnie związany z toczniem u Afroamerykanów w badaniu. Wykazano również , że Afroamerykanie z toczniem wykazują mniejszą ekspresję zredukowanego glutationu w swoich komórkach T. Autorzy badania uważają, że zmniejszona aktywność reduktazy glutationu może przyczynić się do zwiększonej produkcji reaktywnego tlenu u Afroamerykanów z toczniem .
U myszy reduktaza glutationowa jest zaangażowana w wybuch oksydacyjny, składnik odpowiedzi immunologicznej. Wybuch oksydacyjny jest mechanizmem obronnym, w którym neutrofile wytwarzają i uwalniają reaktywne formy utleniające w pobliżu bakterii lub grzybów w celu zniszczenia obcych komórek. Wykazano, że neutrofile z niedoborem reduktazy glutationu wytwarzają bardziej przejściowy wybuch oksydacyjny w odpowiedzi na bakterie niż neutrofile, które wyrażają GR na zwykłym poziomie. Mechanizm reduktazy glutationowej w podtrzymywaniu wybuchu oksydacyjnego jest nadal nieznany.
Niedobór
Niedobór reduktazy glutationowej jest rzadkim zaburzeniem, w którym aktywność reduktazy glutationowej jest nieobecna w erytrocytach , leukocytach lub obu. W jednym badaniu zaburzenie to zaobserwowano tylko w dwóch przypadkach na 15 000 testów na niedobór reduktazy glutationowej wykonanych w ciągu 30 lat. W tym samym badaniu niedobór reduktazy glutationowej był związany z zaćmą i fawizmem u jednego pacjenta i jego rodziny oraz z ciężką niezwiązaną hiperbilirubinemią u innego pacjenta. Zaproponowano, że system redoks glutationu (którego częścią jest reduktaza glutationu) jest prawie wyłącznie odpowiedzialny za ochronę komórek soczewki oka przed nadtlenku wodoru, ponieważ komórki te mają niedobór katalazy , enzymu, który katalizuje rozkład nadtlenku wodoru , oraz wysoki wskaźnik występowania zaćmy u osób z niedoborem reduktazy glutationu.
Niektórzy pacjenci wykazują niedobór aktywności glutationu w wyniku niewystarczającego spożycia ryboflawiny w diecie. Ryboflawina jest prekursorem FAD, której zredukowana forma przekazuje dwa elektrony do wiązania dwusiarczkowego obecnego w utlenionej postaci reduktazy glutationowej w celu rozpoczęcia cyklu katalitycznego enzymu. W 1999 roku badanie wykazało, że 17,8% mężczyzn i 22,4% kobiet badanych w Arabii Saudyjskiej cierpiało na niską aktywność reduktazy glutationu z powodu niedoboru ryboflawiny.
Połączenie z fawizmem
U pacjentów z fawizmem brakuje dehydrogenazy glukozo- 6- fosforanowej , enzymu w szlaku pentozofosforanowym , który redukuje NADP + do NADPH , jednocześnie katalizując konwersję glukozo- 6- fosforanu do 6- fosfoglukono-δ- laktonu . Osoby z niedoborem dehydrogenazy glukozo-6-fosforanowej mają mniej NADPH dostępnego do redukcji utlenionego glutationu poprzez reduktazę glutationową. Stąd ich podstawowy stosunek utlenionego do zredukowanego glutationu jest znacznie wyższy niż u pacjentów, u których normalnie występuje ekspresja dehydrogenazy glukozo-6-fosforanowej, przez co nie są w stanie skutecznie reagować na wysokie poziomy reaktywnych form tlenu, co powoduje lizę komórek.
Monitorowanie aktywności reduktazy glutationowej
Aktywność reduktazy glutationowej jest wykorzystywana jako wskaźnik stresu oksydacyjnego . Aktywność można monitorować przez NADPH , z absorbancją przy 340 nm, lub utworzony GSH można wizualizować za pomocą odczynnika Ellmana . Alternatywnie aktywność można zmierzyć za pomocą roGFP (białka zielonej fluorescencji wrażliwej na redoks).
W roślinach
Podobnie jak w komórkach ludzkich, reduktaza glutationowa pomaga chronić komórki roślinne przed reaktywnymi formami tlenu. W roślinach zredukowany glutation uczestniczy w cyklu glutationowo-askorbinowym , w którym zredukowany glutation redukuje dehydroaskorbinian , reaktywny produkt uboczny redukcji nadtlenku wodoru. W szczególności reduktaza glutationowa przyczynia się do odpowiedzi roślin na stres abiotyczny. Wykazano, że aktywność enzymu jest modulowana w odpowiedzi na metale, metaloidy, zasolenie, suszę, promieniowanie UV i stres wywołany ciepłem.
Historia
Reduktaza glutationowa została po raz pierwszy oczyszczona w 1955 roku na Uniwersytecie Yale przez P. Janmeda. Janmeda zidentyfikował również NADPH jako główny donor elektronów dla enzymu. Późniejsze grupy potwierdziły obecność FAD i grupy tiolowej, a początkowy mechanizm zasugerowano dla mechanizmu w 1965 r. Początkowa (niska rozdzielczość) struktura reduktazy glutationowej została rozwiązana w 1977 r. Po tym szybko nastąpiła struktura 3Å przez Shulze i in. glin. w 1978 r. Reduktaza glutationowa była wyczerpująco badana od czasu tych wczesnych eksperymentów i jest następnie jednym z najlepiej scharakteryzowanych enzymów do tej pory.
Interaktywna mapa szlaków
Interaktywną ścieżkę można znaleźć tutaj: mapa ścieżki
Dalsza lektura
- Sinet PM, Bresson JL, Couturier J, Laurent C, Prieur M, Rethoré MO, Taillemite JL, Toudic D, Jérome H, Lejeune J (1977). „[Możliwa lokalizacja reduktazy glutationu (EC 1.6.4.2) w paśmie 8p21]”. Ann. Genet. (po francusku). 20 (1): 13–7. PMID 302667 .
- Krohne-Ehrich G, Schirmer RH, Untucht-Grau R (1978). „Reduktaza glutationu z ludzkich erytrocytów. Izolacja enzymu i analiza sekwencji peptydu o aktywności redoks”. Eur. J. Biochem . 80 (1): 65–71. doi : 10.1111/j.1432-1033.1977.tb11856.x . PMID 923580 .
- Loos H, Roos D, Weening R, Houwerzijl J (1976). „Rodzinny niedobór reduktazy glutationu w ludzkich komórkach krwi” . Krew . 48 (1): 53–62. doi : 10.1182/krew.V48.1.53.53 . PMID 947404 .
- Tutic M, Lu XA, Schirmer RH, Werner D (1990). „Klonowanie i sekwencjonowanie cDNA reduktazy glutationu ssaków” . Eur. J. Biochem . 188 (3): 523–8. doi : 10.1111/j.1432-1033.1990.tb15431.x . PMID 2185014 .
- Palmer EJ, MacManus JP, Mutus B (1990). „Hamowanie reduktazy glutationowej przez onkomodulinę”. Łuk. Biochem. Biofiza . 277 (1): 149–54. doi : 10.1016/0003-9861(90)90563-E . PMID 2306116 .
- Arnold HH, Heinze H. (1990). „Leczenie ludzkich limfocytów obwodowych konkanawaliną A aktywuje ekspresję reduktazy glutationowej”. FEBS Lett . 267 (2): 189–92. doi : 10.1016/0014-5793(90)80922-6 . PMID 2379581 . S2CID 40084640 .
- Karplus PA, Schulz GE (1987). „Wyrafinowana struktura reduktazy glutationu w rozdzielczości 1,54 A”. J. Mol. Biol . 195 (3): 701–29. doi : 10.1016/0022-2836(87)90191-4 . PMID 3656429 .
- Pai EF, Schulz GE (1983). „Mechanizm katalityczny reduktazy glutationowej wywodzący się z analiz dyfrakcji rentgenowskiej półproduktów reakcji” . J. Biol. chemia . 258 (3): 1752-7. doi : 10.1016/S0021-9258(18)33050-3 . PMID 6822532 .
- Krauth-Siegel RL, Blatterspiel R, Saleh M, Schiltz E, Schirmer RH, Untucht-Grau R (1982). „Reduktaza glutationowa z ludzkich erytrocytów. Sekwencje domeny NADPH i domeny interfejsu”. Eur. J. Biochem . 121 (2): 259–67. doi : 10.1111/j.1432-1033.1982.tb05780.x . PMID 7060551 .
- Thieme R, Pai EF, Schirmer RH, Schulz GE (1982). „Trójwymiarowa struktura reduktazy glutationu w rozdzielczości 2 A”. J. Mol. Biol . 152 (4): 763–82. doi : 10.1016/0022-2836(81)90126-1 . PMID 7334521 .
- Huang J, Philbert MA (1995). „Dystrybucja glutationu i systemów enzymów pokrewnych glutationowi w mitochondriach i cytozolu hodowanych astrocytów móżdżku i komórek ziarnistych”. Mózg Res . 680 (1–2): 16–22. doi : 10.1016/0006-8993(95)00209-9 . PMID 7663973 . S2CID 39710661 .
- Savvides SN, Karplus PA (1996). „Kinetyka i analiza krystalograficzna ludzkiej reduktazy glutationowej w kompleksie z inhibitorem ksantenu” . J. Biol. chemia . 271 (14): 8101–7. doi : 10.1074/jbc.271.14.8101 . PMID 8626496 .
- Nordhoff A, Tziatzios C, van den Broek JA, Schott MK, Kalbitzer HR, Becker K, Schubert D, Schirmer RH (1997). „Denaturacja i reaktywacja dimerycznej ludzkiej reduktazy glutationowej - test na obecność inhibitorów fałdowania” . Eur. J. Biochem . 245 (2): 273–82. doi : 10.1111/j.1432-1033.1997.00273.x . PMID 9151953 .
- Stoll VS, Simpson SJ, Krauth-Siegel RL, Walsh CT, Pai E (1997). „Reduktaza glutationu przekształcona w reduktazę trypanotionu: analiza strukturalna zmodyfikowanej zmiany specyficzności substratu”. Biochemia . 36 (21): 6437–47. doi : 10.1021/bi963074p . PMID 9174360 .
- Becker K, Savvides SN, Keese M, Schirmer RH, Karplus PA (1998). „Inaktywacja enzymów poprzez utlenianie sulfhydrylu przez fizjologiczne nośniki NO”. Nat. Struktura. Biol . 5 (4): 267–71. doi : 10.1038/nsb0498-267 . PMID 9546215 . S2CID 20607289 .
- Kelner MJ, Montoya MA (2000). „Organizacja strukturalna ludzkiego genu reduktazy glutationowej: określenie prawidłowej sekwencji cDNA i identyfikacja mitochondrialnej sekwencji liderowej”. Biochem. Biofiza. Rez. Komuna . 269 (2): 366–8. doi : 10.1006/bbrc.2000.2267 . PMID 10708558 .
- Qanungo S, Mukherjea M (2001). „Profil ontogeniczny niektórych przeciwutleniaczy i peroksydacji lipidów w tkankach ludzkiego łożyska i płodu”. Mol. Komórka. Biochem . 215 (1–2): 11–9. doi : 10.1023/A:1026511420505 . PMID 11204445 . S2CID 22048227 .
- Berry Y, Truscott RJ (2001). „Obecność ludzkiego filtra UV w soczewce oznacza stres oksydacyjny”. Do potęgi. Rez . 72 (4): 411–21. doi : 10.1006/exer.2000.0970 . PMID 11273669 .
- Rhie G, Shin MH, Seo JY, Choi WW, Cho KH, Kim KH, Park KC, Eun HC, Chung JH (2001). „Zależne od starzenia i fotostarzenia zmiany enzymatycznych i nieenzymatycznych przeciwutleniaczy w naskórku i skórze właściwej ludzkiej skóry in vivo” . J. Inwestuj. Dermatol . 117 (5): 1212-7. doi : 10.1046/j.0022-202x.2001.01469.x . PMID 11710935 .
- Zatorska A, Józwiak Z (2003). „Zaangażowanie glutationu i enzymów pokrewnych glutationowi w ochronę normalnych i trisomicznych fibroblastów ludzkich przed daunorubicyną”. Biol komórkowy. Int . 26 (5): 383–91. doi : 10.1006/cbir.2002.0861 . PMID 12095224 . S2CID 31321422 .