Difluoroamino pentafluorek siarki
 |
|
| Nazwy | |
|---|---|
Inne nazwy
|
|
| Identyfikatory | |
|
Model 3D ( JSmol )
|
|
| ChemSpider | |
|
Identyfikator klienta PubChem
|
|
|
Pulpit nawigacyjny CompTox ( EPA )
|
|
|
|
|
|
| Nieruchomości | |
| SF 5 NF 2 | |
| Masa cząsteczkowa | 179,062 g/mol |
| Wygląd | Bezbarwny gaz |
|
O ile nie zaznaczono inaczej, dane podano dla materiałów w stanie normalnym (przy 25°C [77°F], 100 kPa).
|
|
Difluoroamino pentafluorek siarki to gazowy związek chemiczny fluoru, siarki i azotu. Niezwykłe jest posiadanie atomu siarki o koordynacji heksadecymalnej połączonego z azotem. Inne nazwy tej substancji to difluoro(pentafluorosulfur)amina , pentafluorosulfanylodifluoramina i pentafluorosulfanylo N , N -difluoramina .
Nieruchomości
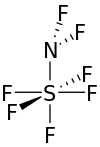
Difluoroamino pentafluorek siarki jest bezbarwnym gazem w temperaturze pokojowej. Cząsteczka ma kształt tetragonalnej bipiramidy wokół atomu siarki.
Z dokładnością do pół stopnia temperatura wrzenia wynosi -17,5 °C.
Difluoroamino pentafluorek siarki jest stabilny w temperaturze pokojowej, ale rozkłada się w skali czasu w ciągu godzin w temperaturze 80 ° C. W wyniku rozkładu powstaje czterofluorek siarki i trójfluorek azotu . Nie jest stabilny powyżej 220 ° C. Jest stabilny z wodą lub stalą nierdzewną.
Przechowywany w kwarcu i wystawiony na działanie światła ultrafioletowego rozkłada się nieznacznie i reaguje z krzemionką, tworząc SF 4 , N 2 F 4 , SF 6 , NF 3 , SO 2 F 2 , SOF 4 i N 2 O .
Wiązanie między siarką a azotem jest dość słabe, a energia dysocjacji wynosi 50 kcal/mol.
Widmo w podczerwieni zawiera silne pasma absorpcji około 885, 910 i 950 cm -1 ze względu na wiązania z fluorem. Jeśli nastąpi silne napromieniowanie laserem o długości fali 910 cm -1 , cząsteczki mogą zostać rozbite, tworząc S 2 F 10 , SF 4 i N 2 F 4 . Dostosowując częstotliwość lasera, rozbicie może być selektywne izotopowo, a także S 2 F 10 może zostać rozbite przez inną pobliską częstotliwość.
Atomy fluoru przyłączone do siarki są przyłączone pod kątem blisko 90° względem siebie, a cztery wokół równika również pod kątem 90° od wiązania siarki z azotem. Kąt oparty na atomach fluoru na atomie azotu wynosi około 98°, a kąt siarka-azot-fluor wynosi około 111°. Odległość między siarką a czterema równikowymi atomami fluoru wynosi 1,545 Å. Osiowa odległość fluoru do siarki wynosi 1,556 Å. Odległość azotu i siarki wynosi około 1,696 Å. Wiązanie fluor-azot jest najkrótsze w cząsteczce przy 1,378 Å.
Przygotowanie
Difluoroamino pentafluorek siarki został przygotowany przez napromieniowanie mieszaniny tetrafluorku diazotu i tetrafluorku siarki światłem ultrafioletowym.
- N 2 fa 4 + 2 SF 4 → 2 SF 5 NF 2 .
Preparat ten działa również z mieszaniną czterofluorku diazotu i pięciofluorku chlorku siarki . Powstanie wymaga pojawienia się rodnika SF 5 i atomów chloru, a także rodnika difluorku azotu .
Innym sposobem wytwarzania pentafluorku difluoroaminosiarki jest ogrzewanie tetrafluorku diazotu i siarki. Powoduje to tymczasowe tworzenie się difluorku azotu . Jednak wydajność wynosi tylko około 6% i powstaje głównie tetrafluorek siarki. Jeszcze innymi substratami czterofluorku diazotu są dekafluorek disiarki lub dwutlenek siarki lub tiofosgen w wyładowaniu elektrycznym.
Wyładowanie koronowe w mieszaninie heksafluorku siarki i azotu wytwarza niewielką ilość pięciofluorku difluoroaminosiarki. Jest to ważne, ponieważ sprzęt wysokiego napięcia jest często izolowany tą kombinacją gazów.
Pentafluorosulfanyloamina reaguje z gazowym fluorem, dając pięciofluorek difluoroaminosiarki:
- SF 5 NH 2 + 2 F 2 → SF 5 NF 2 + 2 HF
Reakcje
Pentafluorek difluoroaminosiarki reaguje z kwasami Lewisa, takimi jak KrF + AsF 6 − w temperaturze -31 ° C, dając SF 6 , Kr, NF 3 i stały N 2 F + AsF 6 − . Z AsF 5 w -196 °C (w postaci cieczy) wytwarza stały N 2 F + AsF 6 − , SF 6 i trans-N 2 F 2 . Podobne produkty pochodzą również z reakcji w temperaturze pokojowej.
Używać
Istnieje rosyjski patent na wykorzystanie kombinacji alkenów i pięciofluorku difluoroaminosiarki jako paliwa rakietowego.
Powiązany
Pokrewne substancje obejmują fluoroimidotrafluorosiarczkę F4S = NF i ( SF5 ) 2NF . Istnieje trzeciorzędowa amina o wzorze (SF 5 ) 3 N.
Inne warianty podstawień na atomie azotu dają SF5NFCI , SF5NHF , SF5NC12 i SF5NH2 .