Kwas podfosforowy
|
|
| Nazwy | |
|---|---|
|
nazwa IUPAC
Kwas poddifosforowy
|
|
| Inne nazwy Kwas difosforowy
|
|
| Identyfikatory | |
|
Model 3D ( JSmol )
|
|
| CHEBI | |
| ChemSpider | |
|
Identyfikator klienta PubChem
|
|
| UNII | |
|
Pulpit nawigacyjny CompTox ( EPA )
|
|
|
|
|
|
| Nieruchomości | |
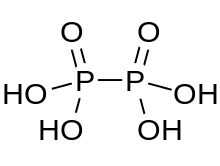
| H 4 P 2 O 6 | |
| Masa cząsteczkowa | 161,98 g/mol |
| Wygląd | Białe ciało stałe (dihydrat) |
| Temperatura topnienia | 54 ° C (129 ° F; 327 K) |
| Baza sprzężona | podfosforan |
|
O ile nie zaznaczono inaczej, dane podano dla materiałów w stanie normalnym (przy 25°C [77°F], 100 kPa).
|
|
Kwas podfosforowy jest kwasem mineralnym o wzorze H 4 P 2 O 6 , z fosforem na formalnym stopniu utlenienia +4. W stanie stałym występuje w postaci dihydratu, H 4 P 2 O 6 ·2H 2 O. W kwasie podfosforowym atomy fosforu są identyczne i połączone bezpośrednio wiązaniem P−P. Kwas izohipofosforowy jest izomerem strukturalnym kwasu podfosforowego, w którym jeden atom fosforu ma bezpośrednio związany wodór i ten atom fosforu jest połączony z drugim atomem przez mostek tlenowy, dając kwas fosforawy / kwas fosforowy bezwodnik mieszany . Dwa atomy fosforu znajdują się odpowiednio na +3 i +5 stopniach utlenienia.
Przygotowanie i reakcje
Kwas podfosforowy można wytworzyć w reakcji czerwonego fosforu z chlorynem sodu w temperaturze pokojowej.
- 2 P + 2 NaClO 2 + 2 H 2 O → Na 2 H 2 P 2 O 6 + 2 HCl
Mieszanina kwasu podfosforowego, kwasu fosforawego (H 3 PO 3 ) i kwasu fosforowego (H 3 PO 4 ) powstaje, gdy biały fosfor utlenia się w powietrzu, gdy jest częściowo zanurzony w wodzie.
Sól tetrasodowa Na4P2O6 · 10H2O krystalizuje przy pH 10 , a sól disodowa Na2H2PO6 · 6H2O przy pH 5,2 . Sól disodową można przepuścić przez kolumnę jonowymienną z wytworzeniem dihydratu kwasu, H 4 P 2 O 6 · 2 H 2 O.
Bezwodny kwas można wytworzyć przez odwodnienie próżniowe nad P 4 O 10 lub przez reakcję H 2 S z podfosforanem ołowiu, Pb 2 P 2 O 6 .
Kwas podfosforowy jest tetraprotonowy ze stałymi dysocjacji p Ka1 = 2,2, p Ka2 = 2,8, p Ka3 = 7,3 i p Ka4 = 10,0 .
Po odstawieniu bezwodny kwas ulega przegrupowaniu i dysproporcjonowaniu, tworząc mieszaninę kwasu izohipofosforowego, HPO(OH)-O-PO 2 (OH); kwas pirofosforowy H 2 P 2 O 7 i kwas pirofosforawy.
Kwas podfosforowy jest nietrwały w gorącym kwasie solnym , w 4 M HCl hydrolizuje dając H 3 PO 3 + H 3 PO 4 .
Struktura
Kwas podfosforowy zawiera jony oksoniowe i jest najlepiej sformułowany [H 3 O + ] 2 [H 2 P 2 O 6 ] 2− . Kwas jest izostrukturalny z solą diamonową, która zawiera anion [HOPO 2 PO 2 OH] 2− o długości wiązania P−P 219 pm.
HOPO 2 PO 2 OH 2− w Na 2 H 2 P 2 O 6 ·6H 2 O ma symetryczną, schodkową strukturę podobną do etanu z wiązaniem P−P o długości 219 pm. Każdy atom fosforu ma dwa wiązania P-O o długości 151 µm i wiązanie P-OH o długości 159 µm.
Sole podfosforanowe
Znanych jest wiele soli podfosforanowych, np. K 4 P 2 O 6 ·8H 2 O, Ca 2 P 2 O 6 ·2H 2 O, K 3 HP 2 O 6 · 3H 2 O, K 2 H 2 P 2 O 6 · 2H2O , KH3P2O6 . _ _ _ _
Stojąc w powietrzu, podfosforany mają tendencję do utleniania się do pirofosforanów zawierających jon P
2 O
4− 7 , w którym P ma formalny stopień utlenienia +5. Podfosforany są odporne na wodorotlenki metali alkalicznych. W skondensowanym wodorotlenku sodu szybko przekształcają się w ortofosforan zawierający PO
3− 4 .
polihipofosforany
Znane są polihipofosforany zawierające aniony liniowe, np. Na 5 P 3 O 8 zawierający O(PO 2 ) 3 O 5− o łańcuchu P−P−P i Na 6 P 4 O 10 ·2H 2 O zawierający O(PO 2 ) 4 O 6− , z łańcuchem P−P−P−P. Anion cykliczny (PO
2 )
6− 6 , (hipoheksametafosforan), w którym każdy atom fosforu ma stopień utlenienia +3, powstaje, gdy zawiesina czerwonego fosforu w KOH jest utleniana bromem.
Zobacz też
- Kwas ditionowy , odpowiednik siarki.