Kinaza nukleozydowo-fosforanowa
| Identyfikatory | |||||||||
|---|---|---|---|---|---|---|---|---|---|
| kinazy fosforanowej nukleozydu | |||||||||
| nr WE | 2.7.4.4 | ||||||||
| nr CAS | 9026-50-0 | ||||||||
| Bazy danych | |||||||||
| IntEnz | Widok IntEnz | ||||||||
| BRENDA | Wpis BRENDY | ||||||||
| ExPASy | Widok NiceZyme | ||||||||
| KEGG | Wpis KEGG | ||||||||
| MetaCyc | szlak metaboliczny | ||||||||
| PRYM | profil | ||||||||
| Struktury PDB | RCSB PDB PDBe PDB suma | ||||||||
| Ontologia genów | AmiGO / QuickGO | ||||||||
| |||||||||
W enzymologii kinaza nukleozydowo-fosforanowa ( EC 2.7.4.4 ) jest enzymem , który katalizuje reakcję chemiczną
- ATP + fosforan nukleozydu ADP + difosforan nukleozydu ⇌ {\ Displaystyle \ rightleftharpoons}
Zatem dwoma substratami tego enzymu są ATP i monofosforan nukleozydu , podczas gdy jego dwoma produktami są ADP i difosforan nukleozydu .
Enzym ten należy do rodziny transferaz , w szczególności tych przenoszących grupy zawierające fosfor ( fosfotransferazy ) z grupą fosforanową jako akceptorem. Systematyczna nazwa tej klasy enzymów to ATP: fosfotransferaza nukleozydowo-fosforanowa . Enzym ten jest również nazywany kinazą NMP lub kinazą monofosforanową nukleozydu .
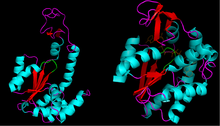
Struktura
Dla tej klasy enzymów rozwiązano wiele struktur krystalicznych , ujawniając, że mają one wspólną domenę wiążącą ATP . Ta część enzymu jest powszechnie określana jako P-pętla , w odniesieniu do jej oddziaływania z grupami fosforylowymi na ATP . Ta domena wiążąca składa się również z arkusza β otoczonego helisami α .
[P-pętla] zazwyczaj ma sekwencję aminokwasową Gly-XXXX-Gly-Lys. Podobne sekwencje znajdują się w wielu innych białkach wiążących nukleotydy.
Mechanizm
Oddziaływanie jonów metali
Aby umożliwić interakcję z tą klasą enzymów, ATP musi najpierw związać się z jonem metalu, takim jak magnez lub mangan . Jon metalu tworzy kompleks z grupą fosforylową, a także z kilkoma cząsteczkami wody. Te cząsteczki wody tworzą następnie wiązania wodorowe z konserwowaną resztą asparaginianu enzymu.
Oddziaływanie jonów metali ułatwia wiązanie, utrzymując cząsteczkę ATP w pozycji umożliwiającej specyficzne wiązanie z miejscem aktywnym i zapewniając dodatkowe punkty wiązania między substratem a enzymem. Zwiększa to energię wiązania .
Zmiany konformacyjne
Wiązanie ATP powoduje ruch pętli P , co z kolei obniża domenę pokrywy i zabezpiecza ATP na miejscu. Wiązanie monofosforanu nukleozydu indukuje dalsze zmiany, które czynią enzym zdolnym katalitycznie do ułatwienia przeniesienia grupy fosforylowej z ATP do monofosforanu nukleozydu .
Konieczność tych zmian konformacyjnych zapobiega marnotrawstwu hydrolizy ATP .
Ten mechanizm enzymatyczny jest przykładem katalizy przez aproksymację: kinaza nukleozydowo-fosforanowa wiąże substraty , łącząc je w prawidłowej pozycji do przeniesienia grupy fosforylowej.
Funkcja biologiczna
Podobne domeny katalityczne są obecne w różnych białkach, w tym:
- syntaza ATP
- Miozyna i inne molekularne białka motoryczne
- Białko G i inne białka zaangażowane w transdukcję sygnału
- Helikazy do rozwijania DNA i RNA
- Metabolizm pirymidyn
Ewolucja
Kiedy utworzono drzewo filogenetyczne złożone z członków rodziny kinaz nukleozydowo-fosforanowych, okazało się, że enzymy te pierwotnie oddzieliły się od wspólnego przodka na odmiany długie i krótkie. Ta pierwsza zmiana była drastyczna – znacząco zmieniła się trójwymiarowa struktura domeny wieczka.
Po ewolucji długich i krótkich odmian kinaz NMP, mniejsze zmiany w sekwencjach aminokwasowych spowodowały zróżnicowanie lokalizacji subkomórkowej.
