Patofizjologia choroby Parkinsona
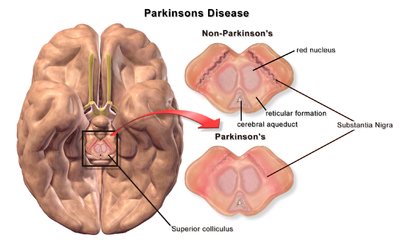 | |
| Śmierć neuronów w mózgu z chorobą Parkinsona | |
|---|---|
| Mózg bez choroby Parkinsona iz chorobą Parkinsona w porównaniu z Substantia Nigra |
Patofizjologia choroby Parkinsona polega na śmierci neuronów dopaminergicznych w wyniku zmian aktywności biologicznej w mózgu w odniesieniu do choroby Parkinsona (PD). Istnieje kilka proponowanych mechanizmów śmierci neuronów w PD; jednak nie wszystkie z nich są dobrze rozumiane. Pięć proponowanych głównych mechanizmów śmierci neuronów w chorobie Parkinsona obejmuje agregację białek w ciałach Lewy'ego , zakłócenie autofagii , zmiany w metabolizmie komórkowym lub funkcje mitochondriów , zapalenie nerwów i uszkodzenie bariery krew-mózg (BBB), powodujące nieszczelność naczyń.
Agregacja białek
Pierwszą główną proponowaną przyczyną śmierci neuronów w chorobie Parkinsona jest wiązanie lub oligomeryzacja białek . Białko alfa-synukleina ma zwiększoną obecność w mózgach pacjentów z chorobą Parkinsona, a ponieważ α-synukleina jest nierozpuszczalna, agreguje, tworząc ciała Lewy'ego (pokazane po lewej) w neuronach. Tradycyjnie uważano, że ciała Lewy'ego są główną przyczyną śmierci komórek w chorobie Parkinsona; jednak nowsze badania sugerują, że ciała Lewy'ego prowadzą do innych skutków, które powodują śmierć komórki. Niezależnie od tego, ciała Lewy'ego są powszechnie uznawane za patologiczny marker choroby Parkinsona.
Ciała Lewy'ego najpierw pojawiają się w opuszce węchowej , rdzeniu przedłużonym i nakrywce mostu ; pacjenci na tym etapie są bezobjawowi. W miarę postępu choroby ciałka Lewy'ego rozwijają się w istocie czarnej , obszarach śródmózgowia i podstawy przodomózgowia oraz w korze nowej .
Mechanizm ten jest potwierdzony faktami, że α-synukleina nie jest toksyczna, gdy nie może tworzyć agregatów; że białka szoku cieplnego, które pomagają w ponownym fałdowaniu białek podatnych na agregację, korzystnie wpływają na PD, gdy ulegają nadekspresji; oraz że odczynniki, które neutralizują zagregowane gatunki, chronią neurony w komórkowych modelach nadekspresji α-synukleiny.
alfa-synukleina jest kluczowym łącznikiem między zmniejszoną naprawą DNA a chorobą Parkinsona. Alfa-synukleina aktywuje ATM ( ataksja-teleangiektazja ), główną kinazę sygnalizacyjną naprawy uszkodzeń DNA . Alfa-synukleina wiąże się z przerwami w dwuniciowym DNA i ułatwia proces naprawy DNA łączenia niehomologicznych końców . Zasugerowano, że cytoplazmatyczna agregacja alfa-synukleiny w celu utworzenia ciałek Lewy'ego zmniejsza jej poziom w jądrze, prowadząc do zmniejszonej naprawy DNA, zwiększonych pęknięć podwójnej nici DNA i zwiększonej zaprogramowana śmierć komórki neuronów .
Zakłócenie autofagii
Drugi główny proponowany mechanizm śmierci neuronów w chorobie Parkinsona, autofagia , to mechanizm, za pomocą którego wewnętrzne składniki komórki są rozkładane i zawracane do użytku. Wykazano, że autofagia odgrywa rolę w zdrowiu mózgu, pomagając regulować funkcje komórkowe. Zakłócenie mechanizmu autofagii może prowadzić do kilku różnych rodzajów chorób, takich jak choroba Parkinsona.
Wykazano również, że dysfunkcja autofagii w chorobie Parkinsona prowadzi do rozregulowanej degradacji mitochondriów .
Zmiany w metabolizmie komórkowym
Trzecia proponowana główna przyczyna śmierci komórek w chorobie Parkinsona dotyczy wytwarzających energię organelli mitochondrialnych . W chorobie Parkinsona funkcja mitochondriów jest zakłócona, co hamuje produkcję energii i prowadzi do śmierci.
Przypuszcza się, że mechanizmem dysfunkcji mitochondriów w chorobie Parkinsona jest kompleks PINK1 i Parkin , który, jak wykazano, napędza autofagię mitochondriów (znaną również jako mitofagia ). PINK1 jest białkiem normalnie transportowanym do mitochondrium, ale może również gromadzić się na powierzchni uszkodzonych mitochondriów. Zgromadzony PINK1 następnie rekrutuje Parkina; Parkin inicjuje rozpad dysfunkcyjnych mitochondriów, mechanizm, który działa jak „kontrola jakości”. Uważa się, że w chorobie Parkinsona geny kodujące PINK1 i Parkin są zmutowane, co zapobiega rozpadowi upośledzonych mitochondriów, powodując nieprawidłowe funkcjonowanie i Morfologia mitochondriów i ostatecznie śmierć komórki Wykazano, że mutacje mitochondrialnego DNA (mtDNA) kumulują się wraz z wiekiem, co wskazuje, że podatność na ten mechanizm śmierci neuronów wzrasta wraz z wiekiem.
Innym związanym z mitochondriami mechanizmem śmierci komórek w chorobie Parkinsona jest wytwarzanie reaktywnych form tlenu (ROS). ROS to wysoce reaktywne cząsteczki, które zawierają tlen i mogą zakłócać funkcje w mitochondriach i reszcie komórki. Wraz z wiekiem mitochondria tracą zdolność usuwania RFT, ale nadal utrzymują produkcję ROS, powodując wzrost produkcji netto ROS i ostatecznie śmierć komórki.
Jak przejrzeli Puspita i in. badania wykazały, że w mitochondriach i retikulum endoplazmatycznym poziomy alfa-synukleiny i dopaminy są prawdopodobnie zaangażowane w przyczynianie się do stresu oksydacyjnego , a także objawów choroby Parkinsona . Wydaje się, że stres oksydacyjny odgrywa rolę w pośredniczeniu w oddzielnych zdarzeniach patologicznych, które razem ostatecznie prowadzą do śmierci komórek w PD. Stres oksydacyjny prowadzący do śmierci komórki może być wspólnym mianownikiem leżącym u podstaw wielu procesów. Stres oksydacyjny powoduje oksydacyjne uszkodzenie DNA . Takie uszkodzenie jest zwiększone w mitochondriach istoty czarnej pacjentów z PD i może prowadzić do śmierci komórek neuronów nigralnych.
Zapalenie nerwów
Czwarty proponowany główny mechanizm śmierci neuronów w chorobie Parkinsona, zapalenie nerwów , jest ogólnie rozumiany dla chorób neurodegeneracyjnych, jednak specyficzne mechanizmy nie są całkowicie scharakteryzowane dla PD. Jednym z głównych typów komórek biorących udział w zapaleniu nerwów jest mikroglej . Mikroglej jest uznawany za wrodzoną komórkę odpornościową ośrodkowego układu nerwowego . Mikroglej aktywnie bada swoje środowisko i znacząco zmienia morfologię komórek w odpowiedzi na uszkodzenie neuronów. Ostre zapalenie w mózgu zazwyczaj charakteryzuje się szybką aktywacją mikrogleju. W tym okresie nie ma obwodowej odpowiedzi immunologicznej. Jednak z czasem przewlekły stan zapalny powoduje degradację tkanki i bariery krew-mózg. W tym czasie wytwarza się mikroglej reaktywne formy tlenu i uwalniają sygnały w celu rekrutacji obwodowych komórek odpornościowych do odpowiedzi zapalnej.
Ponadto wiadomo, że mikroglej ma dwa główne stany: M1, stan, w którym komórki są aktywowane i wydzielają czynniki prozapalne ; i M2, stan, w którym komórki są dezaktywowane i wydzielają przeciwzapalne . Mikroglej jest zwykle w stanie spoczynku (M2), ale w chorobie Parkinsona może wejść do M1 z powodu obecności agregatów α-synukleiny. Mikroglej M1 uwalnia czynniki prozapalne, które mogą powodować śmierć neuronów ruchowych. W takim przypadku umierające komórki mogą uwalniać czynniki zwiększające aktywację mikrogleju M1, co prowadzi do pozytywnego sprzężenia zwrotnego co powoduje stale rosnącą śmierć komórki.
Awaria BBB
Piątym proponowanym głównym mechanizmem śmierci komórki jest rozpad bariery krew-mózg (BBB). BBB ma trzy typy komórek, które ściśle regulują przepływ cząsteczek do iz mózgu: komórki śródbłonka , perycyty i astrocyty . W chorobach neurodegeneracyjnych rozpad BBB został zmierzony i zidentyfikowany w określonych obszarach mózgu, w tym w istocie czarnej w chorobie Parkinsona i hipokampie w chorobie Alzheimera. Agregaty białkowe lub cytokiny z zapalenia nerwów mogą zakłócać receptory komórkowe i zmieniają ich funkcję w BBB. Przede wszystkim uważa się, że czynnik wzrostu śródbłonka naczyniowego (VEGF) i receptory VEGF są rozregulowane w chorobach neurodegeneracyjnych. Interakcja między białkiem VEGF a jego receptorami prowadzi do proliferacji komórek, ale uważa się, że jest zaburzona w chorobie Parkinsona i chorobie Alzheimera. To z kolei powoduje, że komórki przestają rosnąć, a tym samym zapobiega tworzeniu się nowych naczyń włosowatych poprzez angiogenezę . Zakłócenie receptora komórkowego może również wpływać na zdolność komórek do przylegania do siebie złącza przylegające .
Bez tworzenia nowych naczyń włosowatych istniejące naczynia włosowate rozpadają się, a komórki zaczynają się od siebie dysocjować. To z kolei prowadzi do rozpadu połączeń szczelinowych. Połączenia szczelinowe w komórkach śródbłonka w BBB pomagają zapobiegać przedostawaniu się dużych lub szkodliwych cząsteczek do mózgu poprzez regulację przepływu składników odżywczych do mózgu. Jednak w miarę rozpadu połączeń szczelinowych białka osocza są w stanie przedostać się do macierzy zewnątrzkomórkowej mózgu. Mechanizm ten jest również znany jako nieszczelność naczyń, w której zwyrodnienie naczyń włosowatych prowadzi do „przeciekania” krwi i białek krwi do mózgu. Nieszczelność naczyń może ostatecznie spowodować, że neurony zmienią swoją funkcję i przesuną się w kierunku apoptotyczne lub śmierć komórki.
Wpływ na lokomocję
Neurony dopaminergiczne są najbardziej rozpowszechnionym rodzajem neuronów w istocie czarnej , części mózgu regulującej kontrolę motoryczną i uczenie się. Dopamina jest neuroprzekaźnikiem modulującym aktywność neuronów ruchowych w ośrodkowym układzie nerwowym . Aktywowane neurony ruchowe przekazują następnie swoje sygnały, poprzez potencjał czynnościowy , do neuronów ruchowych w rdzeniu kręgowym. Jednakże, gdy znaczny procent neuronów ruchowych umiera (około 50-60%), obniża to poziom dopaminy nawet o 80%. Hamuje to zdolność neuronów do generowania i przesyłania sygnału. To zahamowanie transmisji ostatecznie powoduje charakterystykę Chód parkinsonowski z objawami takimi jak przygarbiony i spowolniony chód lub drżenie.





