Proteaza asparaginianowa
| Eukariotyczna proteaza aspartylowa | |||||||||
|---|---|---|---|---|---|---|---|---|---|
 Struktura dimerycznej proteazy asparaginianowej proteazy HIV w kolorze białym i szarym, z substratem peptydowym w kolorze czarnym i łańcuchami bocznymi asparaginianu w miejscu aktywnym w kolorze czerwonym. ()
| |||||||||
| Identyfikatory | |||||||||
| Symbol | Żmija | ||||||||
| Pfam | PF00026 | ||||||||
| InterPro | IPR001461 | ||||||||
| PROZYTA | PDOC00128 | ||||||||
| SCOP2 | 1mpp / ZAKRES / SUPFAM | ||||||||
| Nadrodzina OPM | 100 | ||||||||
| Białko OPM | 1lyb | ||||||||
| Błona | 315 | ||||||||
| |||||||||
Proteazy asparaginowe (również „proteazy aspartylowe”, „endopeptydazy asparaginianowe”) są katalitycznym typem enzymów proteazowych , które wykorzystują aktywowaną cząsteczkę wody związaną z jedną lub większą liczbą reszt asparaginianowych do katalizy ich substratów peptydowych. Na ogół mają dwa wysoce konserwatywne asparaginiany w miejscu aktywnym i są optymalnie aktywne w kwaśnym pH . Prawie wszystkie znane proteazy aspartylowe są hamowane przez pepstatynę .
Endopeptydazy asparaginianowe EC 3.4.23. scharakteryzowano pochodzenie kręgowców, grzybów i retrowirusów. Niedawno opisano endopeptydazy asparaginianowe związane z przetwarzaniem bakteryjnej prepiliny typu 4 i archaicznej preflagelliny.
Eukariotyczne proteazy asparaginianowe obejmują pepsyny , katepsyny i reniny . Mają strukturę dwudomenową, wynikającą z duplikacji przodków. retrowirusowe i retrotranspozonowe ( retrowirusowe proteazy aspartylowe ) są znacznie mniejsze i wydają się być homologiczne z pojedynczą domeną eukariotycznych proteaz aspartylowych. Każda domena wnosi katalityczną resztę Asp, z rozszerzoną szczeliną miejsca aktywnego zlokalizowaną między dwoma płatami cząsteczki. Jeden płat prawdopodobnie wyewoluował z drugiego w wyniku duplikacji genów w odległej przeszłości. We współczesnych enzymach, chociaż struktury trójwymiarowe są bardzo podobne, sekwencje aminokwasowe są bardziej rozbieżne, z wyjątkiem motywu miejsca katalitycznego, który jest bardzo konserwatywny. Obecność i położenie mostków dwusiarczkowych to inne konserwatywne cechy peptydaz asparaginianowych.
Mechanizm katalityczny
Proteazy aspartylowe to wysoce specyficzna rodzina proteaz – mają tendencję do rozszczepiania wiązań dipeptydowych, które mają reszty hydrofobowe, a także grupę beta-metylenową. W przeciwieństwie do proteaz serynowych lub cysteinowych , te proteazy nie tworzą kowalencyjnego związku pośredniego podczas cięcia. Proteoliza zachodzi zatem w jednym etapie.
Chociaż zaproponowano wiele różnych mechanizmów proteaz aspartylowych, najszerzej akceptowanym jest ogólny mechanizm kwasowo-zasadowy obejmujący koordynację cząsteczki wody między dwiema wysoce konserwatywnymi resztami asparaginianu . Jeden asparaginian aktywuje wodę poprzez abstrakcję protonu, umożliwiając wodzie przeprowadzenie ataku nukleofilowego na węgiel karbonylowy wiązania rozszczepialnego substratu , generując tetraedryczny związek pośredni oksyanionu stabilizowany przez wiązanie wodorowe z drugim kwasem asparaginowym. Przegrupowanie tego związku pośredniego prowadzi do protonowania scissile amidu , co skutkuje rozszczepieniem peptydu substratowego na dwa peptydy produktowe.
Zahamowanie
Pepstatyna jest inhibitorem proteaz asparaginianowych.
Klasyfikacja
pięć nadrodzin (klanów) proteaz asparaginianowych, z których każda reprezentuje niezależną ewolucję tego samego miejsca aktywnego i mechanizmów . Każda nadrodzina zawiera kilka rodzin o podobnych sekwencjach. Systematyczna klasyfikacja MEROPS te klany alfabetycznie.
- Klan AA (np. rodzina Pepsin )
- Klan AC (np. Rodzina peptydazy sygnałowej II )
- Klan AD (np. rodzina Presenilin )
- Klan AE (np. rodzina endopeptydaz GPR )
- Klan AF (np. rodzina Omptin )
propeptyd
| A1_Propeptydowe | |||||||||
|---|---|---|---|---|---|---|---|---|---|
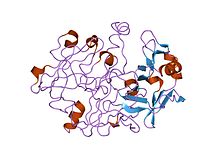 struktury krystaliczne i molekularne ludzkiej progastrycyny w rozdzielczości 1,62 angstremów
| |||||||||
| Identyfikatory | |||||||||
| Symbol | A1_Propeptyd | ||||||||
| Pfam | PF07966 | ||||||||
| InterPro | IPR012848 | ||||||||
| |||||||||
Wiele eukariotycznych endopeptydaz asparaginianowych (rodzina peptydaz MEROPS A1) jest syntetyzowanych z sygnałowymi i propeptydami . Propeptydy pepsyny tworzą odrębną rodzinę propeptydów, które zawierają konserwatywny motyw o długości około 30 reszt . W pepsynogenie A pierwsze 11 reszt dojrzałej sekwencji pepsyny jest zastąpione resztami propeptydu. Propeptyd zawiera dwie helisy które blokują szczelinę miejsca aktywnego , w szczególności konserwowaną resztę Asp11, w pepsynie, tworzą wiązania wodorowe z konserwowaną resztą Arg w propeptydzie. To wiązanie wodorowe stabilizuje konformację propeptydu i jest prawdopodobnie odpowiedzialne za wyzwalanie konwersji pepsynogenu do pepsyny w warunkach kwaśnych .
Przykłady
Człowiek
- BACE1 , BACE2
- Katepsyna D
- Katepsyna E
- Chymozyna (lub „renina”)
- Napsin-A
- Nepenthesin
- pepsyna
- Presenilina
- Renina
Białka ludzkie zawierające tę domenę
BACE1 ; BACE2 ; CTSD ; CTSE ; NAPSA ; PGA5 ; PGC ; REN ;
Inne organizmy
- Proteaza HIV-1 – główny cel leków w leczeniu HIV
- Plazmepsyna – grupa proteaz aspartylowych występująca w pasożytach powodujących malarię Plasmodium
Zobacz też
Linki zewnętrzne
- MEROPS dotycząca peptydaz i ich inhibitorów : peptydazy asparaginowe
- Asparaginian + endopeptydazy w Amerykańskiej Narodowej Bibliotece Medycznej Medical Subject Headings (MeSH)
- MEROPS rodzina A1
