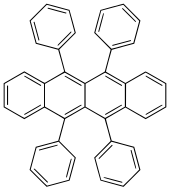
Rubrene
|
|

|
|

|
|
| Nazwy | |
|---|---|
|
Preferowana nazwa IUPAC
5,6,11,12-Tetrafenylotetracen |
|
| Inne nazwy 5,6,11,12-Tetrafenylonaftacen, rubren
|
|
| Identyfikatory | |
|
Model 3D ( JSmol )
|
|
| ChemSpider | |
| Karta informacyjna ECHA | 100.007.494 |
| Numer WE |
|
|
Identyfikator klienta PubChem
|
|
|
Pulpit nawigacyjny CompTox ( EPA )
|
|
|
|
|
|
| Nieruchomości | |
| C 42 H 28 | |
| Masa cząsteczkowa | 532,7 g/mol |
| Temperatura topnienia | 315 ° C (599 ° F; 588 K) |
|
O ile nie zaznaczono inaczej, dane podano dla materiałów w stanie normalnym (przy 25°C [77°F], 100 kPa).
|
|
Rubren ( 5,6,11,12-tetrafenylotetracen ) to wielopierścieniowy węglowodór aromatyczny o czerwonym zabarwieniu . Rubrene jest używany jako sensybilizator w chemoluminescencji i jako źródło żółtego światła w pałeczkach świetlnych .
Właściwości elektroniczne
Jako organiczny półprzewodnik , rubren jest głównie stosowany w organicznych diodach elektroluminescencyjnych (OLED) i organicznych tranzystorach polowych , które są podstawowymi elementami elastycznych wyświetlaczy. Tranzystory monokrystaliczne można przygotować przy użyciu krystalicznego rubrenu, który hoduje się w piecu ze zmodyfikowaną strefą w gradiencie temperatury. Ta technika, znana jako fizyczny transport pary, została wprowadzona w 1998 roku.
Rubrene wyróżnia się tym, że jest półprzewodnikiem organicznym o najwyższej ruchliwości nośników, sięgającej 40 cm 2 /(V·s) dla dziur . Wartość tę zmierzono w OFET przygotowanych przez oderwanie cienkiej warstwy monokrystalicznego rubrenu i przeniesienie na podłoże Si/SiO 2 .
Struktura krystaliczna
kilka polimorfów rubrenu. Kryształy wyhodowane z pary w próżni mogą mieć motywy jednoskośne , trójskośne i rombowe . Kryształy rombowe ( grupa przestrzenna B bam ) otrzymuje się w układzie zamkniętym w piecu dwustrefowym pod ciśnieniem otoczenia.
Synteza
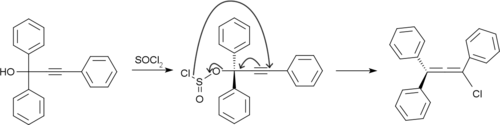
Rubrene wytwarza się przez traktowanie 1,1,3-trifenylo-2-propyn-1-olu chlorkiem tionylu .
Otrzymany chloroallen ulega dimeryzacji i odchlorowodorowaniu , dając rubren.
Właściwości redoks
Rubren, podobnie jak inne wielopierścieniowe cząsteczki aromatyczne, ulega w roztworze reakcjom redoks. Utlenia się i redukuje odwracalnie przy 0,95 V i -1,37 V odpowiednio w stosunku do SCE . Kiedy kation i anion są współgenerowane w ogniwie elektrochemicznym, mogą łączyć się z anihilacją swoich ładunków, ale wytwarzają wzbudzoną cząsteczkę rubrenu, która emituje przy 540 nm. Zjawisko to nazywane jest elektrochemiluminescencją .