Tarakserol

|
|
| Nazwy | |
|---|---|
|
nazwa IUPAC
13-Metylo-27-nor-13α-olean-14-en-3β-ol
|
|
|
Preferowana nazwa IUPAC
(3S , 4aR , 6aR , 8aR , 12aR , 12bS , 14aR , 14bR )-4,4,6a,8a, 11,11,12b ,14b-oktametylo-1,2,3, 4,4a,5,6,6a,8,8a,9,10,11,12,12a,12b,13,14,14a,14b-ikozahydropicen-3-ol |
|
Inne nazwy
|
|
| Identyfikatory | |
|
Model 3D ( JSmol )
|
|
| ChemSpider | |
|
Identyfikator klienta PubChem
|
|
| UNII | |
|
|
|
|
| Nieruchomości | |
| C 30 H 50 O | |
| Masa cząsteczkowa | 426,729 g·mol -1 |
| Wygląd | Bezbarwne ciało stałe |
|
O ile nie zaznaczono inaczej, dane podano dla materiałów w stanie normalnym (przy 25°C [77°F], 100 kPa).
|
|
Taraxerol jest naturalnie występującym pentacyklicznym triterpenoidem . Występuje w różnych roślinach wyższych, w tym Taraxacum officinale ( Asteraceae ), Alnus glutinosa ( Betulaceae ), Litsea dealbata ( Lauraceae ), Skimmia spp. ( Rutaceae ), Dorstenia spp. ( Moraceae ), Maytenus spp. ( Celastraceae ) i Alchornea latifolia ( Euphobiaceae ). Taraxerol został nazwany „alnuliną”, kiedy został po raz pierwszy wyizolowany w 1923 roku z kory olszy szarej ( Alnus incana L.) przez Zellnera i Röglspergera. Miał również nazwę „skimmiol”, kiedy Takeda i Yosiki wyizolowali go z Skimmia ( Rutaceae ). Wiadomo, że wiele roślin leczniczych zawiera ten związek w liściach, korzeniach lub oleju z nasion.
Chemia
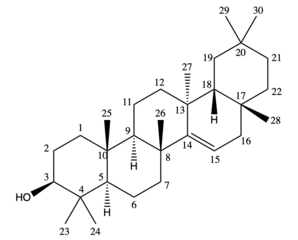
Struktura
Taraxerol to oleanan-3-ol z podstawnikiem alfa- metylowym w pozycji 13, brakującą grupą metylową w pozycji 14 i podwójnym wiązaniem między 14 a 15. Dominującym stereoizomerem biologicznym w liściach roślin i osadach jest taraxer-14 -en-3β-ol konfiguracja. Tarakserol jest izomerem podwójnego wiązania β-amyryny , innego ważnego naturalnie występującego triterpenoidu w roślinach wyższych. Jest to bezbarwne ciało stałe w temperaturze pokojowej o szacowanej temperaturze topnienia 283,50 ° C i temperaturze wrzenia 490,70°C. Jest praktycznie nierozpuszczalny w wodzie i ma rozpuszczalność 9,552 × 10-5 mg /l obliczoną na podstawie współczynnika podziału oktanol-woda .
Synteza
Chociaż ogólnie udowodniono, że syntezy pentacyklicznych triterpenoidów są trudne, Ursprung i in. z α- i β-amyryny. Wystawienie etanolowego roztworu α- i β-amyryny na działanie letniego światła słonecznego przez 12 tygodni daje bezbarwny osad, a zmydlanie osadu daje 11,12-α-oksydotarakserol. Alternatywnie, proces można przyspieszyć przez wystawienie etanolowego roztworu β-amyryny na światło ultrafioletowe. W takim przypadku osad można zebrać w mniej niż 3 tygodnie.
Transformacja w osadzie
Podczas wczesnej diagenezy tarakserol traci swoją grupę hydroksylową i przekształca się w tarakser-14-en. Taraxer-14-en może ulegać szybkiej izomeryzacji, tworząc 18β-olean-12-en, w którym wiązanie podwójne może migrować i tworzyć mieszaninę olean-12-enu, olean-13 (18) -enu i olean-18 -en. Izomery oleanu powstają szybko w wyniku przegrupowań taraxerolu podczas diagenezy, nawet w chłodnych warunkach geotermalnych. Dalsza redukcja podczas katagenezy tych trzech związków daje głównie 18α-oleanan i jego odpowiednik 18β-oleanan jako produkt drugorzędny. Produkt bezpośredniej redukcji taraxerolu, taraxerane, jest prawie nieobecny w osadach naturalnych. Oleanane wydaje się być dominującym produktem w wyniku procesu transformacji.
Biomarker
Taraxerol występuje zwykle w niewielkich ilościach w ekstraktach roślinnych i może być stosowany jako biomarker lipidowy dla roślin lądowych. Jednak w wielu gatunkach liści drzew namorzynowych, np. Rhizophora mangle (czerwony namorzyn) i Rhizophora racemosa , taraxerol występuje w bardzo dużych ilościach. Dlatego jest używany w różnych badaniach jako wskaźnik zastępczy dla wkładu namorzynowego. W obrębie różnych gatunków namorzynów istnieją również różnice w składzie. Na przykład magiel Rhizophora zawiera wysokie poziomy taraxerolu, β-amyryny, germanicolu i lupeolu , Avicennia germinans (namorzyn czarny) składa się głównie z lupeolu, betuliny i β-sitosterolu , a Laguncularia racemosa (namorzyn biały) charakteryzuje się dużymi ilościami lupeolu i β-sitosterolu.
Studium przypadku biomarkera namorzynowego
Rhizophora racemosa reprezentuje dominujące gatunki namorzynowe w równikowej i podrównikowej Afryce Zachodniej. Versteegh i in. przeanalizowali lipidy liści R. racemosa , a także osady powierzchniowe i rdzenie osadów z basenu Angoli i basenu przylądkowego (południowo-wschodni Atlantyk), aby ocenić przydatność stosowania tarakserolu jako wskaźnika zastępczego dla wkładu namorzynów w osadach morskich. Hipoteza jest taka, że powinien istnieć „poziom podstawowy” dla tarakserolu w ogólnych osadach i podwyższony poziom w miejscach, w których Rhizophora ma znaczący udział.
Analiza sugeruje, że tarakserol dominuje wewnątrz iw całym składzie liści R. racemosa (7,7 mg/g liścia). W rezultacie wzrost poziomu tarakserolu w stosunku do innych wyższych biomarkerów roślinnych w osadach powinien wskazywać, kiedy i gdzie Rhizophora ma znaczący udział. W przeważającej części południowo-wschodniego Atlantyku tarakserol/normalne alkany C 29 (nC 29 ) w osadach powierzchniowych jest niski. Wysokie wskaźniki obserwuje się w strefie wzdłuż zbocza kontynentalnego, w której maksima występują zawsze w pobliżu dzisiejszych namorzynowych drzew nadbrzeżnych. Ten wzorzec silnie potwierdza związek między wysokimi poziomami taraxerolu a wkładem z ekosystemów namorzynowych. Ten związek jest również wspierany przez podobny, choć mniej wyraźny trend w Rhizophora .
Badanie rdzeni osadów ujawnia dalsze powiązania między populacją namorzynów, poziomami taraxerolu i warunkami klimatycznymi. Jednym z ważnych warunków klimatycznych jest zlodowacenie/deglacjacja. Podczas deglacjacji, kiedy tempo wzrostu poziomu mórz przekraczało 12 cm/100 lat, populacje namorzynów nie mogły przetrwać z powodu braku dostaw osadów. Po spowolnieniu tego tempa populacje namorzynów mogą ponownie się rozprzestrzenić w świeżo rozwiniętych ujściach rzek i deltach. Jednak okresy rozwoju namorzyn i wzrostu poziomu tarakserolu w dorzeczu czasami nie pokrywają się ze sobą. W czasach szybkiego podnoszenia się poziomu mórz przybrzeżne osady namorzynowe mogą być transportowane do basenu, co powoduje wzrost napływu tarakserolu, podczas gdy rozwój namorzynów faktycznie nastąpi później. W niektórych innych przypadkach, w których wahania poziomu tarakserolu nie były związane ze zmianami poziomu morza, można je również przypisać lokalnym wahaniom temperatury i wilgotności.
Metody analizy
Metody analityczne służące do oznaczania i oznaczania ilościowego tarakserolu obejmują chromatografię gazową/spektroskopię masową (GC/MS) oraz wysokosprawną chromatografię cienkowarstwową (HPTLC).
GC/MS
Istnieje kilka procedur obróbki przed analizą GC/MS próbek liści lub osadów zawierających tarakserol. Wysuszone i zmielone próbki są zmydlane mocną zasadą (np. wodorotlenkiem potasu ), ekstrahowane polarnym rozpuszczalnikiem (np. dichlorometanem ), rozdzielane na frakcje metodą chromatografii kolumnowej , a na końcu derywatyzowane. Typowe opcje derywatyzacji obejmują N -metylo- N- (trimetylosililo)trifluoroacetamid (MSTFA) i mieszaninę pirydyny i bis(trimetylosililo)trifluoroacetamidu (BSTFA), z których oba mają na celu przekształcenie wolnych grup hydroksylowych w etery trimetylosililowe , czyniąc cząsteczki bardziej niepolarnymi, a tym samym bardziej odpowiednimi do analizy GC/MS. W GC/MS taraxerol ma charakterystyczny pik ze stosunkiem masy do ładunku (m/z) równym 204.
HPTLC
Alternatywnie, oznaczenie i oznaczenie ilościowe tarakserolu można również osiągnąć z dobrą wiarygodnością i odtwarzalnością za pomocą HPTLC. W tym przypadku przeprowadza się liniowy rozwój rosnący (np. stosując heksan i octan etylu (8:2 obj./obj.) jako fazę ruchomą) w szklanej komorze z podwójnymi korytami na aluminiowych płytkach TLC. Oznaczenie ilościowe można przeprowadzić przez skanowanie spektrodensytometryczne przy długości fali 420 nm.
Badania farmakologiczne
Wykazano, że Taraxerol, podobnie jak wiele związków triterpenoidowych, ma działanie przeciwzapalne in vitro . Może zakłócać aktywację enzymów MAP3K7 (TAK1) , kinazy białkowej B (PKB lub Akt) i NF-κB . W ten sposób może hamować ekspresję mediatorów prozapalnych w mikrofagach.
Tarakserol wykazuje również działanie przeciwnowotworowe. Dwuetapowe testy karcynogenezy in vivo guza skóry myszy wykazały, że tarakserol może hamować indukcję wczesnego antygenu wirusa Epsteina-Barr (EBV-EA) przez inicjator nowotworu 7,12-dimetylobenz(a)antracen (DMBA) i promotor nowotworu 12-O-tetradekanoiloforbol-13-octan (TPA).
Ponadto tarakserol może hamować aktywność acetylocholinoesterazy (AChE) w hipokampie szczura .