Utlenianie Rubottoma
| Utlenianie Rubottoma | |
|---|---|
| Nazwany po | George’a M. Rubottoma |
| Typ reakcji | Organiczna reakcja redoks |
| Identyfikatory | |
| Portal chemii organicznej | |
Utlenianie Rubottoma jest użyteczną, wysokowydajną reakcją chemiczną pomiędzy eterami sililoenolowymi i nadtlenokwasami , w wyniku której otrzymuje się odpowiedni produkt α-hydroksykarbonylowy. Mechanizm reakcji został zaproponowany w pierwotnym ujawnieniu przez AG Brook, a dalsze dowody dostarczone później przez George'a M. Rubottoma. Po eteru sililoenolowego za pomocą nadtlenku typu Prilezhaeva z wytworzeniem półproduktu siloksyoksiranowego , katalizowane kwasem otwarcie pierścienia daje oksokarben jon. Ten związek pośredni uczestniczy następnie w migracji 1,4-sililu ( przegrupowanie Brooka ), dając pochodną α-siloksykarbonylową, którą można łatwo przekształcić w związek α-hydroksykarbonylowy w obecności kwasu, zasady lub źródła fluorku.
Mechanizm reakcji
Historia
W 1974 roku trzy niezależne grupy doniosły o reakcji znanej obecnie jako utlenianie Rubottoma: AG Brook, A. Hassner i GM Rubottom. Istniał już znaczący precedens dla tej reakcji. Na przykład już w latach trzydziestych XX wieku wiedziano, że związki β-dikarbonylowe o wysokiej enolizowalności będą reagować z nadtlenokwasami, chociaż dopiero w latach pięćdziesiątych i sześćdziesiątych XX wieku faktycznie produktem były związki α-hydroksy β-dikarbonylowe.
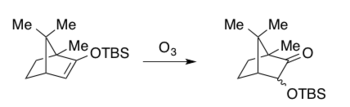
Znacząca praca AG Brooka z lat pięćdziesiątych XX wieku dotycząca mechanizmów migracji krzemoorganicznych, znanych obecnie jako rearanżacje Brooka . W 1974 roku CH Heathcock opisał ozonolizę eterów sililowo-enolowych z wytworzeniem produktu w postaci kwasu karboksylowego poprzez rozszczepienie oksydacyjne, podczas którego migracje sililów obserwowano jako reakcje uboczne i wyłącznie w przypadku układu bicyklicznego.
Główne cechy
Oryginalne wdrożenia utleniania Rubottoma obejmowały nadtlenkowy kwas meta-chloronadbenzoesowy (mCPBA) jako utleniacz w dichlorometanie (DCM) w przypadku Hassnera i Brooka oraz heksany w przypadku Rubottoma. Chociaż od 1974 r. reakcję udoskonalano i modyfikowano, mCPBA jest nadal powszechnie stosowany jako utleniacz, z nieco większymi różnicami w doborze rozpuszczalnika. Najpopularniejszym rozpuszczalnikiem pozostaje DCM, a następnie różne rozpuszczalniki węglowodorowe, w tym pentan i toluen. Warto zauważyć, że reakcja przebiega w stosunkowo niskich temperaturach i ogrzewanie powyżej temperatury pokojowej nie jest konieczne. Niskie temperatury pozwalają na dostosowanie standardowych warunków utleniania Rubottom do różnych wrażliwych grup funkcyjnych, co czyni je idealnymi do syntezy złożonych cząsteczek (patrz przykłady syntezy poniżej). Substraty eteru sililoenolowego można wytwarzać regioselektywnie z ketonów lub aldehydów, stosując termodynamiczną lub kinetyczną kontrolę enolizacji przed wyłapywaniem z pożądanego źródła krzemoorganicznego (zwykle chlorku lub triflatu, np. TBSCl lub TBSOTf). Jak ilustrują poniższe przykłady syntezy, etery sililoenolowe można wyodrębnić przed poddaniem warunkom reakcji lub surowy materiał można natychmiast poddać utlenianiu bez izolowania. W ten sposób można wytworzyć zarówno acykliczne, jak i cykliczne pochodne eteru sililoenolowego, które następnie można zastosować jako substraty w utlenianiu Rubottoma. Poniżej znajdują się niektóre reprezentatywne produkty utleniania Rubottoma zsyntetyzowane w nowatorskich artykułach.
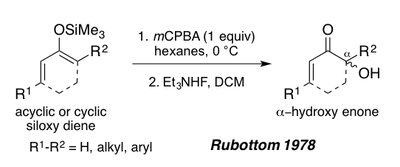
W 1978 Rubottom wykazał, że siloksy-1,3-dieny, pochodzące od acyklicznych lub cyklicznych enonów, mogą również służyć jako substraty do utleniania Rubottoma w celu wytworzenia α-hydroksyenonów po obróbce fluorkiem trietyloamoniowym. Substraty te dają w warunkach reakcji pojedynczy regioizomer ze względu na bogatą w elektrony naturę wiązania pi-sililoenolowego (patrz synteza Periplanonu B poniżej).
Modyfikacje i ulepszenia
Utlenianie Rubottoma pozostało w dużej mierze niezmienione od czasu jego pierwotnego ujawnienia, ale jedną z głównych wad standardowych warunków jest środowisko kwaśne, które może prowadzić do niepożądanych reakcji ubocznych i degradacji. Aby złagodzić ten problem, powszechnie stosuje się prosty układ buforowy wodorowęglanu sodu, co jest szczególnie problematyczne w syntezach bicyklicznych i innych złożonych cząsteczek (patrz przykłady syntezy). Wprowadzenie utleniaczy chiralnych umożliwiło także syntezę enancjomerycznie czystych pochodnych α-hydroksykarbonylu z odpowiadających im eterów sililowo-enolowych. Pierwszy przykład enancjoselektywnego utleniania Rubottoma został opublikowany przez FA Davis w 1987 i przedstawił metodologię chiralnej oksazyrydyny Davisa ( utlenianie Davisa ), dającą dobre wydajności, ale umiarkowane nadmiary enancjomeryczne . W 1992 roku KB Sharpless wykazał, że asymetryczna dihydroksylacja warunki opracowane w jego grupie można wykorzystać do otrzymania (R) - lub (S) - α-hydroksyketonów z odpowiednich eterów sililowo-enolowych, w zależności od tego, które chiralne ligandy pochodzące z alkaloidu Chinchona zostały zastosowane. Grupy Y. Shi i W. Adama opublikowały inny enancjoselektywny wariant utleniania Rubottoma w 1998 r. przy użyciu chiralnego ketonu Shi w obecności oksonu w układzie buforowanym w celu uzyskania α-hydroksyketonów z dużą wydajnością i wysokim nadmiarem enancjomerycznym . Grupa Adam opublikowała także w 1998 roku kolejną pracę wykorzystującą kompleksy manganu(III)-(Salenu) w obecności NaOCl (wybielacza) jako utleniacza i N-tlenku 4-fenylopirydyny jako dodatku w układzie buforowanym fosforanami. Metodologia ta zapewniła również wysokie wydajności i enentioselektywność w przypadku eterów sililoenolowych, a także acetali sililoketenowych pochodzących z estrów.
Oprócz chiralnych utleniaczy zbadano warianty mCPBA. Stankovic i Espenson opublikowali odmianę utleniania Rubottoma, w której metylotrioksorren stosuje się jako utleniacz katalityczny w obecności stechiometrycznego nadtlenku wodoru . Metodologia ta pozwala uzyskać acykliczne i cykliczne α-hydroksyketony z dużą wydajnością przy użyciu taniego, dostępnego w handlu utleniacza. Nieodłącznym problemem mCPBA jest jego niezdolność do utleniania acetali sililoketenu. Do syntezy estrów α-hydroksylowych potrzebne są różne utleniacze, takie jak NaOCl (patrz wyżej), octan ołowiu (IV) lub kompleks kwas podfluorowy-acetonitryl (HOF-ACN). Grupa Rubottom stwierdziła, że octan ołowiu (IV) w DCM lub benzenie daje dobrą wydajność acyklicznych i cyklicznych estrów α-hydroksylowych po potraktowaniu surowej mieszaniny reakcyjnej fluorkiem trietyloamoniowym. Później S. Rozen zastosował wysoce elektrofilowy kompleks HOF-ACN do utleniania różnych bogatych w elektrony eterów sililowo-enolowych, acetali sililoketenowych i bis(acetali sililowych) pochodzących z kwasów karboksylowych, z dobrą wydajnością w temperaturze pokojowej lub niższej .
Zastosowania w syntezie
Poniższe przykłady reprezentują tylko niewielką część syntez, które podkreślają zastosowanie utleniania Rubottoma w celu zainstalowania ważnej funkcjonalności α-hydroksy. Niektóre z głównych cech poniższych syntez obejmują zastosowanie warunków buforowanych w celu ochrony wrażliwych substratów i diastereoselektywną instalację grupy α-hydroksylowej ze względu na kontrolowane przez substrat odchylenie twarzy. Więcej przykładów znajdziesz w ref
Utlenianie Rubottoma wykorzystano do syntezy periplanonu B , feromonu płciowego wydalanego przez samicę karalucha amerykańskiego . W syntezie wykorzystano anionowe przegrupowanie oksy-Cope połączone z utlenianiem Rubottoma. Po ogrzaniu w obecności wodorku potasu (KH) i 18-korona-6 (18-C-6), aby uzyskać anionowy oksy-Cope, enolanowy związek pośredni uwięziono chlorkiem trimetylosililu (TMSCl). Półprodukt eteru sililoenolowego można następnie poddać działaniu mCPBA w warunkach utleniania Rubottoma, otrzymując pożądany związek α-hydroksykarbonylowy, który można następnie przenieść do (±)-peryplanonu B i jego diastereoizomerów w celu potwierdzenia jego struktury.
Brewizamid, proponowany biosyntetyczny prekursor polieterowej toksyny morskiej, został zsyntetyzowany przez Ghosha i Li, a jednym z etapów jest utlenianie Rubottoma cyklicznego eteru sililowo-enolowego w warunkach buforowanych. Chiralny katalizator chromowy B został opracowany przez grupę Jacobsena i zapewnia wysoki poziom enancjo- i diastereoselektywności. Stereocentra dogodnie ustawione w reakcji Dielsa-Aldera kierują utlenianie na stronę mniej zawadzoną, dając pojedynczy diastereoizomer, który można następnie przeprowadzić w kolejnych 14 etapach do Brewizamidu.
Wang i współpracownicy opracowali solidną syntezę w skali kilogramowej silnej pochodnej 2S-hydroksymutyliny z pleuromutyliny, antybiotyku wytwarzanego przez różne gatunki podstawczaków . Zasadowa hydroliza mająca na celu usunięcie reszty estru hydroksylowego pleuromutyliny dała mutylinę. Późniejsze traktowanie heksametylodisilazydkiem litu (LiHMDS) i TMSCl dało eter sililoenolowy chroniony TMS, który natychmiast poddano działaniu kwasu octowego - (HOAc) pirydyny - (Py) buforowane utlenianie Rubottoma przed hydrolizą kwasową, w wyniku czego otrzymuje się 2S-hydroksymutylinę. Ta wysoce zoptymalizowana sekwencja ma dwa ważne aspekty. Najpierw autorzy pierwotnie wygenerowali eter sililoenolowy przy użyciu trietyloaminy, co dało mieszaninę pożądanego produktu kinetycznego (pokazanego poniżej) niepożądanego produktu termodynamicznego i hydrolizę z powrotem do mutyliny. Autorzy obwiniają powstawanie kwaśnego produktu ubocznego trietyloamoniowego (pKa = 10,6) za niepożądane produkty uboczne i zaradzili temu, stosując LiHMDS do tworzenia wyłącznie pożądanego produktu kinetycznego bez reakcji ubocznych katalizowanych kwasem ze względu na znacznie niższą kwasowość protonowanego produktu (pKa = 26). Po drugie, chociaż utlenianie zachodziło od pożądanej wypukłej powierzchni eteru sililoenolowego, autorzy zaobserwowali znaczną liczbę produktów nadmiernego utleniania, które przypisywali stabilności pośredniego jonu oksokarbenu w warunkach buforowanych wodorowęglanem sodu. Postawili hipotezę, że wydłużony czas życia związków pośrednich umożliwi wystąpienie nadmiernego utleniania. Po znacznej optymalizacji stwierdzono, że bufor HOAc/Py wychwytywał półprodukt oksokarbenowy i zapobiegał nadmiernemu utlenieniu, dając wyłącznie 2S-hydroksymutylinę po hydrolizie sililowych grup zabezpieczających.
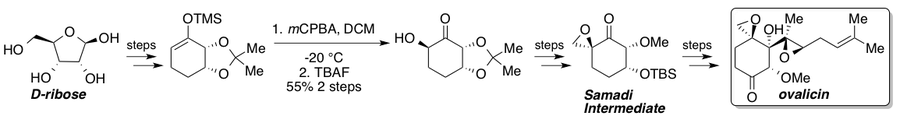
Owalicyna, fumagillina i ich pochodne wykazują silne właściwości przeciwangiogenetyczne i od czasu ich izolacji przeszły liczne syntezy całkowite. Corey i Dittami opisali pierwszą całkowitą syntezę racemicznej owalicyny w 1985 r., po której nastąpiły dwie syntezy asymetryczne opisane w 1994 r. przez Samadiego i Coreya, które obejmowały strategię chiralnej puli odpowiednio z L- kwebrachitolu i asymetrycznej dihydroksylacji. W 2010 roku Yadav i współpracownicy opisali trasę, która przecinała trasę Samadi z chiralnego materiału wyjściowego D- rybozy . Standardowe utlenianie Rubottoma daje pojedynczy stereoizomer ze względu na kontrolę substratu i stanowi kluczowy stereogeniczny etap na drodze do ketonu Samadi. Po zsyntetyzowaniu keton Samadi można przekształcić w (-) -owalicynę w znanych etapach.
Welutinol A został po raz pierwszy zsyntetyzowany przez Isakę i współpracowników. Autorzy wykazali, że wysoka regioselektywność tej reakcji jest kierowana przez syn grupy hydroksylowej do protonu fuzyjnego pierścienia. Reakcje, w których stereochemia grupy hydroksylowej jest odwrócona, powodują niższą regioselektywność, a usunięcie grupy hydroksylowej spowodowało wyłącznie utworzenie innego regioizomeru. Jest prawdopodobne, że bliskość grupy hydroksylowej w izomerze syn zakwasza proton fuzji pierścieniowej poprzez interakcje wiązań wodorowych, ułatwiając w ten sposób regioselektywną deprotonację przez trietyloaminę. Następnie eter sililoenolowy potraktowano nadmiarem mCPBA, aby ułatwić „podwójne” utlenianie Rubottoma, w wyniku czego otrzymano produkt egzo z obiema grupami hydroksylowymi na zewnątrz skondensowanego układu pierścieniowego. Ten produkt dihydroksylowy następnie przekształcono w welutinol A w trzech dodatkowych etapach.
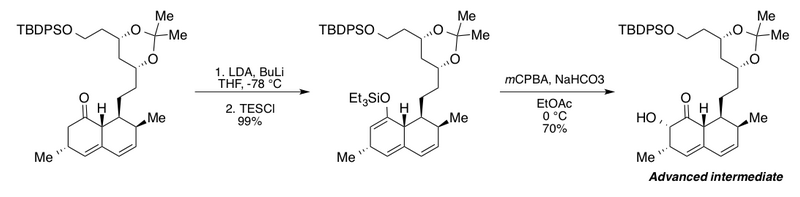
Grupa Clive wykorzystała utlenianie Rubottoma w syntezie zaawansowanego półproduktu do badań degradacji mewinoliny , metabolitu grzyba obniżającego cholesterol . Ta interesująca sekwencja obejmuje dodanie nadmiaru n-butylolitu (BuLi) w obecności diizopropyloamidu litu (LDA) w celu pełnej konwersji pochodnej bicyklicznego ketonu do odpowiedniego eteru sililoenolowego. Bez BuLi autorzy podają maksymalną wydajność wynoszącą zaledwie 72%. Późniejsze warunki utleniania Rubottoma w buforowanych warunkach za pomocą wodorowęglanu sodu w octanie etylu dały α-hydroksyketon w postaci pojedynczego diastereoizomeru.
Grupa Falk zsyntetyzowała różne pochodne fosfatydylo-D-mio-inozytolu, aby pomóc w badaniu różnych szlaków sygnalizacji komórkowej 3-kinazy fosfatydyloinozytolu (PI3K). Ich droga do zbierania analogów substratów wykorzystuje kontrolowane przez substrat stereoselektywne utlenianie Rubottoma przy użyciu dimetylodioksiranu (DMDO) jako utleniacza i katalitycznego kwasu kamforosulfonowego (CSA) wspomagającego hydrolizę. Dla grup zabezpieczających patrz ref
Problemy i niedociągnięcia
Chociaż utlenianie Rubottoma na ogół daje dobre wydajności i jest wysoce skalowalne (patrz synteza 2S-hydroksymutyliny), nadal występują pewne problemy z reakcją. Jak wspomniano powyżej, wiele złożonych substratów nie toleruje kwaśnych warunków reakcji, ale można to zniwelować stosując układy buforowe. Poważnym problemem w tej reakcji jest również słaba gospodarka atomowa, ponieważ wymaga ona utleniacza stechiometrycznego, który generuje duże ilości odpadów. Praca z nadtlenkami może być również niebezpieczna. Wiadomo, że mCPBA wybucha w wyniku wstrząsu lub iskier.
Chociaż etery sililoenolowe aldehydów i ketonów są tradycyjnymi substratami do utleniania Rubottoma, jak wspomniano powyżej, acetale sililoketenu i bis (acetale sililowe) można utlenić do ich α-hydroksyestrów lub pochodnych kwasu karboksylowego przy użyciu octanu ołowiu (IV) lub kwas podfluorowy - acetonitryl (HOF – ACN). Jednakże te α-hydroksylacje nie zachodzą przez półprodukty w postaci eteru sililoenolowego i dlatego technicznie rzecz biorąc nie są to utleniania Rubottoma. Do utlenienia wielu z tych pochodnych karbonylowych po ich przekształceniu w odpowiedni enolan lub pokrewny anion można zastosować różne utleniacze. Niektóre typowe utleniacze to kwasy nadtlenowe, tlen cząsteczkowy i odczynniki hiperwalentnego jodu.
Bibliografia
- Kurti, L.; Czakó, B. (2005) Strategiczne zastosowania nazwanych reakcji w syntezie organicznej , Elsevier, ISBN 0124297854 .
- Li, JJ (2009) Reakcje na nazwy: zbiór szczegółowych mechanizmów i zastosowań syntetycznych , wydanie 4, Springer, ISBN 8132204298