absynt

|
|
|
|
| Nazwy | |
|---|---|
|
nazwa IUPAC
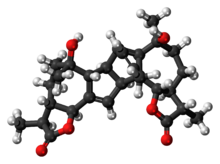
(1R,2R,5S,8S,9S,12S,13R,14S,15S,16R,17S,20S,21S,24S)-12,17-dihydroksy-3,8,12,17,21,25-heksametylo- 6,23-dioksaheptacyklo[13.9.2.01,16.02,14.04,13.05,9.020,24]heksakoza-3,25-dien-7,22-dion
|
|
| Identyfikatory | |
|
Model 3D ( JSmol )
|
|
| CHEBI | |
| CHEMBL | |
| ChemSpider | |
|
Identyfikator klienta PubChem
|
|
| UNII | |
|
Pulpit nawigacyjny CompTox ( EPA )
|
|
|
|
|
|
| Nieruchomości | |
| C 30 H 40 O 6 | |
| Masa cząsteczkowa | 496.635 |
|
O ile nie zaznaczono inaczej, dane podano dla materiałów w stanie normalnym (przy 25°C [77°F], 100 kPa).
|
|
Absyntyna to naturalnie wytwarzany lakton triterpenowy z rośliny Artemisia absinthium ( Piołun ). Stanowi jeden z najbardziej gorzkich środków chemicznych odpowiedzialnych za wyrazisty smak absyntu . Związek wykazuje aktywność biologiczną i okazał się obiecujący jako środek przeciwzapalny i nie należy go mylić z tujonem , neurotoksyną występującą również w Artemisia absinthium .
Struktura chemiczna
Złożona struktura absyntyny (1) jest klasyfikowana jako lakton seskwiterpenowy, co oznacza, że należy do dużej kategorii produktów naturalnych otrzymywanych chemicznie z 5-węglowych „cegiełek” (3) pochodzących z izoprenu (4 ) . Kompletna struktura składa się z dwóch identycznych monomerów (2), które są przyłączone poprzez podejrzewaną naturalnie występującą Dielsa Aldera zachodzącą w alkenach na 5-członowym pierścieniu gwajanolidu .
Totalna synteza
Całkowita synteza (+)-absyntyny została przeprowadzona w 2004 roku przez Zhanga i in. Końcowa wydajność syntezy wynosiła 18,6% w ciągu 10 etapów pochodzących z dostępnego w handlu odczynnika Santonin (1). Podstawą syntezy było rozszerzenie pierścienia pierwotnego 6-członowego pierścienia węglowego do pierścienia 7-członowego, powodujące powstanie rusztowania z monomeru gwajanolidu (2), a następnie sprzęganie Dielsa Aldera (3) i końcowe modyfikacje stereochemiczne prowadzące do (+)-Absyntyna (4).

Biosynteza
Pełna biosynteza absyntu w Artemisia absinthium nie została wyjaśniona, ale dużą jej część można wywnioskować z prekursorów produktów naturalnych wymaganych do uzyskania dostępu do absyntu. Chociaż można powiedzieć, że terpenoidy, takie jak absyntina, składają się z „jednostek” izoprenu , sam izopren jest zbyt stabilny i nie reaguje bezpośrednio. Raczej jednostki izoprenowe są przenoszone i reagują jako difosforany. Jak sugeruje nazewnictwo terpenów, pierwszy prekursor absyntyny, difosforan farnezylu [A] zawiera 15 atomów węgla, czyli 3 jednostki izoprenowe. Odejście difosforanu (1) generuje karbo-kation w obrębie syntazy, który może następnie zostać zaatakowany przez podwójne wiązanie węgiel-węgiel na przeciwległym końcu cząsteczki (2). Pierwszym stabilnym związkiem pośrednim w szlaku biosyntezy u artemizji jest prawdopodobnie Germacrene A [B], który został wcześniej zidentyfikowany w roślinnych szlakach seskwiterpenowych jako prekursor gwajanolidów. Stamtąd zachodzi hydroksylacja (3), po której następuje utlenianie (4) do aldehydu, po którym bezpośrednio następuje dalsza hydroksylacja (5) i tworzenie grupy karboksylowej. Należy zwrócić uwagę na zanik końcowego wiązania podwójnego węgiel-węgiel po (4), ponieważ redukcja tego wiązania w produkcie końcowym odróżnia monomer absyntyny od innych dalszych produktów Germacrene A. Ta redukcja niekoniecznie zachodzi w etapie (4), ale może wystąpić dalej w dół. Gdy grupa karboksylowa i hydroksylowa znajdują się w pozycji, może wystąpić tworzenie guaiano-laktonu [C] poprzez odwodnienie (7), jak zaproponowano dla ogólnego szlaku guaianolidowego. Następnie postuluje się, że tworzenie monomeru seskwiterpenowego gwajanolidu absyntyny [D] z hydroksylacji i przegrupowania wiązania podwójnego (8,9) bezpośrednio poprzedza dimeryzację do absyntyny [E] poprzez naturalnie występującą reakcję Dielsa-Aldera [10], co jest prawdopodobnie ułatwione przez powiązana syntaza, chociaż sama reakcja może zachodzić spontanicznie z dobrą wydajnością, aczkolwiek wolniej niż typowa biosynteza produktu naturalnego.
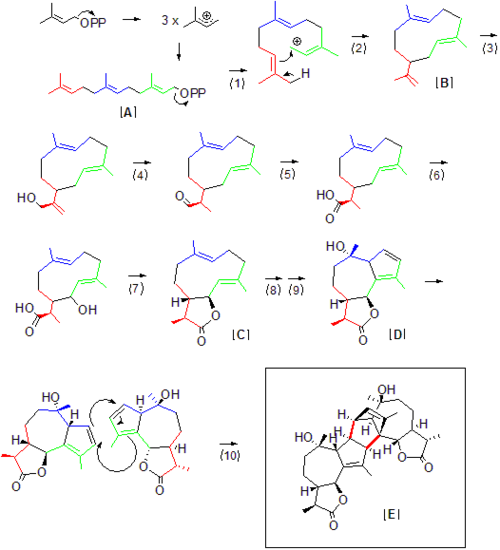
Chociaż żadne syntazy specyficzne dla Artemisia absinthium nie zostały wystarczająco wyizolowane, aby odtworzyć tę konkretną formację seskwiterpenu in vitro, przedstawiony tutaj ogólny schemat reakcji przedstawia prawdopodobny scenariusz biosyntezy absyntu poprzez zastosowanie półproduktów terpenowych wykorzystywanych w biosyntezie Germacrene A, innego laktonu seskwiterpenowego . Enzymatyczne analogi z biosyntezy terpenów, które pomagają zracjonalizować proponowane powyżej ponumerowane etapy biosyntezy, są następujące:
- difosforanu farnezylu przez ogólną syntazę seskwiterpenową
- Zamknięcie pierścienia za pomocą ogólnej syntazy seskwiterpenowej (jak w przypadku nr 1)
- Hydroksylacja końcowego węgla allilowego przez hydroksylazę Germacrene A, enzym cytochromu P450.
- Utlenianie alkoholu do aldolu przez hydroksylazę -germakrenu A.
- Hydroksylacja alkoholu do grupy karboksylowej przez hydroksylazę Germacrene A.
- NADPH poprzez postulowaną hydroksylację poprzedzającą zamknięcie pierścienia laktonowego
- Tworzenie laktonu/zamknięcie pierścienia
- Hydroksylacja przy trzeciorzędowym wiązaniu podwójnym węgiel-węgiel.
- Dodatkowe tworzenie/cyklizacja pierścienia 5-członowego
- Dielsa-Aldera przez niezidentyfikowany enzym w Artemisia absinthium .
Linki zewnętrzne
-
 Media związane z Absyntem w Wikimedia Commons
Media związane z Absyntem w Wikimedia Commons
