fagi Ff
Fagi Ff (dla fagów nitkowatych swoistych dla F ) to grupa prawie identycznych fagów nitkowatych (rodzaj Inovirus ) obejmująca fagi f1 , fd, M13 i ZJ/2, które infekują bakterie niosące czynnik płodności F. Wirion (cząsteczka wirusa) to elastyczne włókno o wymiarach około 6 na 900 nm , zawierające cylindryczną rurkę białkową chroniącą jednoniciową kolistą cząsteczkę DNA w swoim rdzeniu. Fag koduje tylko 11 produktów genów i jest jednym z najprostszych znanych wirusów. Jest szeroko stosowany do badania podstawowych aspektów biologii molekularnej. George Smith i Greg Winter wykorzystali f1 i fd w swojej pracy nad prezentacją na fagach , za co otrzymali część Nagrody Nobla w dziedzinie chemii w 2018 roku . Wczesne eksperymenty na fagach Ff wykorzystywały M13 do identyfikacji funkcji genów, a M13 opracowano również jako nośnik do klonowania, więc nazwa M13 jest czasami używana jako nieformalny synonim całej grupy fagów Ff.
Struktura
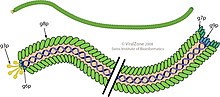
Wirion jest elastycznym włóknem ( łańcuch podobny do robaka ) o średnicy około 6 nm i długości 900 nm. Kilka tysięcy kopii małej (50 reszt aminokwasowych) wydłużonej alfa-helikalnej głównej podjednostki białka otoczki (produkt genu 8 lub p8) w zachodzącym na siebie układzie podobnym do gontu tworzy wydrążony cylinder obejmujący kolisty jednoniciowy genom DNA . Każda podjednostka p8 ma zbiór reszt zasadowych w pobliżu C-końca wydłużonego białka i reszt kwasowych w pobliżu N-końca; te dwa regiony są oddzielone około 20 resztami hydrofobowymi (niepolarnymi). Układ podobny do gontu umieszcza kwaśne pozostałości p8 w pobliżu zewnętrznej powierzchni cylindra, gdzie powodują ujemne naładowanie cząsteczki wirusa; regiony niepolarne w pobliżu regionów niepolarnych sąsiednich podjednostek p8, gdzie interakcje niepolarne przyczyniają się do znacznej stabilności fizycznej cząsteczki wirusa; i reszty zasadowe w pobliżu środka cylindra, gdzie oddziałują z ujemnie naładowanymi fosforanami DNA w rdzeniu wirionu. Dłuższe (lub krótsze) cząsteczki DNA mogą być pakowane, ponieważ podczas składania można dodać więcej (lub mniej) podjednostek p8, zgodnie z wymogami ochrony DNA, dzięki czemu fag jest przydatny w badaniach genetycznych. (Efektu tego nie należy mylić z polifagiem , który może pakować kilka oddzielnych i odrębnych cząsteczek DNA). Około 5 kopii każdego z czterech mniejszych białek pokrywa dwa końce wirionu.
Strukturę molekularną kapsydu wirionu (zespół białek podjednostki p8) określono metodą dyfrakcji rentgenowskiej na włóknach , a modele strukturalne zdeponowano w Protein Data Bank . W szczególności serie struktur wirionów fd i Pf1 zdeponowanych w PDB na przestrzeni dziesięcioleci ilustrują ulepszenia metod dyfrakcji włókien i analizy obliczeniowej. Struktury białka kapsydu p3 i białka replikacji/montażu p5 zostały również określone na podstawie krystalografii rentgenowskiej i zdeponowane w PDB. [ potrzebne źródło ]
Genetyka
Sekwencja DNA genomu fd ma 6408 nukleotydów zawierających 9 genów, ale genom ma 11 otwartych ramek odczytu wytwarzających 11 białek, ponieważ dwa geny, gen 2 i gen 1, mają wewnętrzne inicjacje translacji w ramce, generujące dwa dodatkowe białka, p10 i p11. Genom zawiera również krótką niekodującą sekwencję międzygenową. Sekwencje M13 i f1 różnią się nieco od fd. Oba mają tylko 6407 nukleotydów; f1 różni się od fd w 180 pozycjach (tylko 10 z tych zmian znajduje odzwierciedlenie w zmianach aminokwasów w produktach genów), a M13 ma tylko 59 różnic nukleotydowych od f1. Z wielu powodów fagi z grupy Ff można uważać za wymienne.
Pięć produktów genów jest częścią wirionu: główne białko płaszcza (p8) i mniejsze białka pokrywające dwa końce, p3 i p6 na jednym końcu oraz p7 i p9 na drugim końcu. Trzy produkty genów (p2, p5 i p10) to białka cytoplazmatyczne potrzebne do syntezy DNA, a pozostałe to białka błonowe zaangażowane w składanie wirionu.
| Inowirus | |
|---|---|
| Klasyfikacja wirusów | |
| (nierankingowe): | Wirus |
| królestwo : | Monodnaviria |
| Królestwo: | Loebvirae |
| Gromada: | Hofneiviricota |
| Klasa: | Faservicetes |
| Zamówienie: | Tubulawirusy |
| Rodzina: | Inoviridae |
| Rodzaj: | inowirus |
Gen kodujący p1 został użyty jako konserwatywny gen markerowy, wraz z trzema innymi cechami specyficznymi dla genomów inowirusów, w automatycznym podejściu do uczenia maszynowego w celu identyfikacji ponad 10 000 sekwencji podobnych do inowirusów z genomów drobnoustrojów.
Koło życia
Infekcja
Białko p3 jest zakotwiczone na jednym końcu wirionu przez C-końcową domenę p3. Zakażenie bakterii gospodarza obejmuje interakcję dwóch różnych regionów N-końcowych p3 z dwoma różnymi miejscami bakterii gospodarza. Najpierw domena N2 p3 przyczepia się do zewnętrznej końcówki pilusa F , a pilus cofa się do komórki. To wycofanie może obejmować depolimeryzację zespołu podjednostki pilusa do błony komórkowej u podstawy pilusa przez odwrócenie procesu wzrostu i polimeryzacji pilusa. Gdy czubek pilusa z p3 zbliża się do ściany komórkowej, domena N1 p3 oddziałuje z bakteryjnym białkiem TolQRA, aby zakończyć infekcję i uwolnić genom do cytoplazmy gospodarza.
Replikacja
Po wejściu do cytoplazmy jednoniciowy wirusowy DNA służy jako matryca do syntezy komplementarnej nici DNA. Ta synteza jest inicjowana w międzygenowym regionie sekwencji DNA przez polimerazę RNA gospodarza, która syntetyzuje krótki starter RNA na infekującym DNA jako matrycę. Polimeraza DNA gospodarza III wykorzystuje następnie ten starter do syntezy pełnej komplementarnej nici DNA, tworząc dwuniciowe koło, czasami nazywane DNA w formie replikacyjnej (RF). Komplementarna nić RF jest matrycą transkrypcyjną dla białek kodowanych przez fagi, zwłaszcza p2 i p10, które są niezbędne do dalszej replikacji DNA. [ potrzebne źródło ]
Białko p2 rozszczepia wirusową nić RF DNA, a polimeraza DNA gospodarza III syntetyzuje nową nić wirusową. Stara nić wirusowa jest zastępowana podczas syntezy nowej. Kiedy koło jest kompletne, kowalencyjnie połączone p2 przecina przemieszczoną nić wirusową na połączeniu starego i nowo zsyntetyzowanego DNA i ponownie łączy dwa końce i uwalnia p2. RF replikuje się za pomocą tego toczącego się koła , aby wygenerować dziesiątki kopii RF. [ potrzebne źródło ]
Kiedy stężenie białek fagowych wzrasta, nowe nici wirusowe są pokryte raczej białkiem replikacyjnym/montażowym p5 niż komplementarnymi niciami DNA. P5 hamuje również translację p2, tak że produkcja ssDNA wirusa potomnego i pakowanie są zsynchronizowane.
Montaż i wytłaczanie
Infekcja nie zabija bakterii gospodarza, w przeciwieństwie do większości innych rodzin fagów. Fagi potomne są składane, gdy przechodzą przez błonę rosnących bakterii, prawdopodobnie w miejscach adhezji łączących błonę wewnętrzną i zewnętrzną. Pięć białek faga, które tworzą otoczkę ukończonego faga, wchodzi do błony wewnętrznej; dla p8 i p3 N-końcowe sekwencje liderowe (później usunięte) pomagają białkom dostać się do błony bakteryjnej, z ich N-końcami skierowanymi od cytoplazmy w kierunku peryplazmy. Trzy inne białka błonowe faga , które nie są obecne w fagu, p1, p11 i p4, są również zaangażowane w składanie. Replikacja DNA RF jest przekształcana w wytwarzanie ssDNA faga przez powlekanie DNA p5 w celu utworzenia wydłużonego kompleksu replikacja/montaż p5/DNA, który następnie oddziałuje z białkami faga związanymi z błoną. Proces wytłaczania pobiera białka p7 i p9, które tworzą zewnętrzną końcówkę faga potomnego. Gdy p5 jest usuwane z DNA, DNA potomne jest wytłaczane przez membranę i owijane w spiralną osłonkę p8, do której dodaje się p3 i p6 na końcu składania. Białko p4 może tworzyć pory wytłaczania w błonie zewnętrznej.
Interakcja dwuniciowego sygnału upakowania DNA z kompleksem p1-tioredoksyny w błonie wewnętrznej gospodarza wyzwala tworzenie się porów. Białko p1 zawiera motywy Walkera , które są niezbędne do składania faga, co sugeruje, że p1 jest motorem molekularnym zaangażowanym w składanie faga. Białko p1 ma obejmującą błonę domenę hydrofobową z częścią N-końcową w cytoplazmie i częścią C-końcową w peryplazmie (odwrotność orientacji p8). Do cytoplazmatycznej strony domeny rozciągającej się na błonę przylega 13-resztowa sekwencja p1 mająca wzór reszt zasadowych ściśle odpowiadający wzorowi reszt zasadowych w pobliżu C-końca p8, ale odwrócony w stosunku do tej sekwencji.
Pośrednie zespoły p8 można wytworzyć przez traktowanie faga chloroformem. Spiralna zawartość p8 w tych formach pośrednich jest podobna do tej w fagu, co sugeruje, że zmiana strukturalna podczas składania może obejmować tylko przesuwanie się gontowych podjednostek p8 względem ich sąsiadów w zespole.
Aplikacje
Nauki o życiu i medycyna
Fagi Ff zostały zaprojektowane do zastosowań w naukach biologicznych i medycznych. Wiele zastosowań opiera się na eksperymentach pokazujących, że sekwencję DNA warunkującą oporność na antybiotyk kanamycynę można wstawić w formie funkcjonalnej do niekodującej sekwencji międzygenowej DNA faga fd. Takie zmodyfikowane fagi są odpowiednio dłuższe niż nitkowate fd typu dzikiego, ponieważ dłuższe DNA jest pokryte odpowiednio większą liczbą białek otoczki genu 8, ale cykl życiowy faga nie jest w inny sposób zakłócony. Z drugiej strony tradycyjna „kijanka” lub fag o kształcie izometrycznym, które mają kapsyd o ograniczonej wielkości, nie mogą być tak łatwo użyte do kapsułkowania większej cząsteczki DNA. Zmodyfikowany fag można wyselekcjonować przez infekowanie bakterii wrażliwych na kanamycynę zmodyfikowanym fagiem w celu wprowadzenia oporności na kanamycynę i hodowanie zainfekowanych bakterii w pożywce zawierającej kanamycynę w innym przypadku śmiertelnym stężeniu. [ potrzebne źródło ]
Wynik ten rozszerzono przez wstawienie obcego DNA wyrażającego obcy peptyd do genu 3 faga fd, a nie do sekwencji międzygenowej, tak że obcy peptyd pojawia się na powierzchni faga jako część białka adsorpcyjnego genu 3. Faga niosącego obcy peptyd można następnie wykryć przy użyciu odpowiednich przeciwciał. Odwrotnością tego podejścia jest wstawienie DNA kodującego przeciwciała do genu 3 i wykrycie ich obecności za pomocą odpowiednich antygenów.
Techniki te zostały rozszerzone na przestrzeni lat na wiele sposobów, na przykład poprzez wstawienie obcego DNA do genów kodujących białka płaszcza faga inne niż gen 3 i/lub duplikację genu będącego przedmiotem zainteresowania w celu zmodyfikowania tylko niektórych odpowiednich produktów genowych. Technologia prezentacji fagowej jest szeroko stosowana do wielu celów.
Nauki o materiałach i nanotechnologia
Fagi Ff zostały zaprojektowane do zastosowań takich jak remediacja, elektrochemiczne, fotowoltaiczne, katalityczne, czujnikowe i cyfrowe urządzenia pamięciowe, zwłaszcza przez Angelę Belcher i współpracowników. [ nadmierne cytowania ]