glikoforyna
| Glikoforyna A | |||||||||
|---|---|---|---|---|---|---|---|---|---|
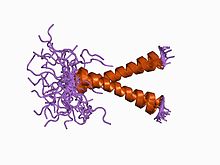 Dimeryczna domena transbłonowa ludzkiej glikoforyny A (struktury określone za pomocą 20 NMR)
| |||||||||
| Identyfikatory | |||||||||
| Symbol | GYPA | ||||||||
| Pfam | PF01102 | ||||||||
| InterPro | IPR001195 | ||||||||
| PROZYTA | PDOC00281 | ||||||||
| SCOP2 | 1afo / ZAKRES / SUPFAM | ||||||||
| Nadrodzina OPM | 25 | ||||||||
| Białko OPM | 5eh4 | ||||||||
| Błona | 156 | ||||||||
| |||||||||
Glikoforyna jest sialoglikoproteiną błony czerwonej krwinki . _ _ Jest białkiem obejmującym błonę i przenosi cząsteczki cukru. Jest silnie glikozylowany (60%). Glikoforyny są bogate w kwas sialowy , który nadaje krwinkom czerwonym bardzo hydrofilową powłokę. Dzięki temu mogą krążyć bez przylegania do innych komórek lub ścian naczyń.
Uważa się, że określona mutacja w glikoforynach powoduje 40% zmniejszenie ryzyka ciężkiej malarii.
Identyfikacja
Po rozdzieleniu błon krwinek czerwonych za pomocą elektroforezy w żelu poliakrylamidowym z SDS i wybarwieniu kwasem nadjodowym (PAS) zidentyfikowano cztery glikoforyny. Zostały one nazwane glikoforyną A, B, C i D w kolejności ilości obecnej w błonie, przy czym glikoforyna A jest najbardziej powszechna, a glikoforyna D najmniej powszechna. Piąta ( glikoforyna E ) została zidentyfikowana w ludzkim genomie, ale nie można jej łatwo wykryć za pomocą rutynowego barwienia żelu. W sumie glikoforyny stanowią ~2% całkowitej liczby erytrocytów masa białkowa błony. Białka te są również znane pod różnymi nomenklaturami, ale prawdopodobnie najlepiej znane są jako glikoforyny.
Członkowie rodziny
Następujące cztery ludzkie geny kodują białka glikoforyny:
Obecnie wiadomo, że glikoforyna D jest odmianą glikoforyny C.
Linki zewnętrzne
- Glikoforyna w US National Library of Medicine Medical Subject Headings (MeSH)
- UMich Orientacja białek w błonach białkowych/pdbid-1afo