metan
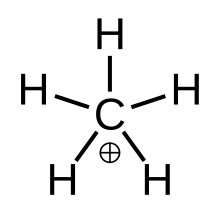 „Prawdziwy” metan, metastabilny stan przejściowy CH
+ 5 |
|
 Fluxional metan, CH
3 (H 2 ) + |
|
| Nazwy | |
|---|---|
| Inne nazwy carbonium (zniechęcony z powodu wielu definicji)
|
|
| Identyfikatory | |
|
Model 3D ( JSmol )
|
|
|
Identyfikator klienta PubChem
|
|
|
|
|
|
| Nieruchomości | |
| CH 5 + | |
| Masa cząsteczkowa | 17,050 g · mol -1 |
| Baza sprzężona | Metan |
| Struktura | |
| Trygonalny bipiramidalny | |
|
O ile nie zaznaczono inaczej, dane podano dla materiałów w stanie normalnym (przy 25°C [77°F], 100 kPa).
|
|
W chemii metan jest złożonym jonem dodatnim o wzorze [ CH
3 (H
2 ) ] + , a mianowicie cząsteczką z jednym atomem węgla związanym z trzema atomami wodoru i jedną cząsteczką wodoru, mającą ładunek elektryczny +1 . Jest superkwasem i jednym z jonów onium , a nawet najprostszym jonem karboniowym .
Jest wysoce niestabilny i wysoce reaktywny nawet po uzyskaniu pełnego oktetu, co nadaje mu właściwości nadkwasowe.
Metan można wytwarzać w laboratorium jako gaz rozrzedzony lub jako rozcieńczony związek w superkwasach. Został on przygotowany po raz pierwszy w 1950 roku i opublikowany w 1952 roku przez Victora Talrose'a i jego asystentkę Annę Konstantinovną Lyubimovą. Występuje jako gatunek pośredni w reakcjach chemicznych.
Jon metanowy został nazwany na cześć metanu ( CH
4 ), przez analogię do pochodzenia jonu amonowego ( NH
+ 4 ) z amoniaku ( NH
3 ).
Struktura
Fluksalny metan można zwizualizować jako jon karbeniowy CH
+ 3 z cząsteczką wodoru oddziałującą z pustym orbitalem w wiązaniu 3-centrum-2-elektronowym . Wiążąca para elektronów w cząsteczce H 2 jest wspólna dla dwóch atomów wodoru i jednego atomu węgla, tworzących wiązanie 3-centralne-2-elektronowe.
Dwa atomy wodoru w cząsteczce H 2 mogą w sposób ciągły wymieniać pozycje z trzema atomami wodoru w jonie CH
+ 3 (zmiana konformacji zwana pseudorotacją , w szczególności mechanizm Berry'ego ). Dlatego jon metanu jest uważany za cząsteczkę fluksyjną . Bariera energetyczna dla wymiany jest dość niska i występuje nawet w bardzo niskich temperaturach.
Do uzyskania informacji o różnych konformacjach jonu metanu wykorzystano spektroskopię w podczerwieni . Widmo IR zwykłego metanu ma dwa pasma CH od symetrycznego i asymetrycznego rozciągania przy około 3000 cm -1 oraz dwa pasma wokół 1400 cm -1 od symetrycznych i asymetrycznych drgań zginających. W widmie CH
+ 5 występują trzy asymetryczne drgania rozciągające w okolicach 2800-3000 cm -1 , drgania kołyszące przy 1300 cm -1 i drgania zginające przy 1100 1300 cm -1 .
Przygotowanie
Metan można wytworzyć z metanu przez działanie bardzo silnych kwasów, takich jak kwas fluoroantymonowy ( pentafluorek antymonu SbF
5 w fluorowodorze HF).
Przy ciśnieniu około 270 Pa i temperaturze otoczenia jon metanu CH
+ 4 będzie reagował z obojętnym metanem, dając metan i rodnik metylowy :
-
CH
+ 4 + CH
4 → CH
+ 5 + CH
• 3
Jon metanu można również wytworzyć w fazie gazowej w reakcji metanu z jonem H+ (tj. protonem). [ potrzebne źródło ]
CH 4 + H + (g) → CH 5 +
Stabilność i reakcje
Kationy otrzymane w reakcji metanu z SbF
5 + HF , w tym metan, są stabilizowane przez oddziaływania z cząsteczkami HF.
Przy niskim ciśnieniu (około 1 mmHg) i temperaturze otoczenia metan nie reaguje z obojętnym metanem.
Zobacz też
- ^ Chemia, Międzynarodowa Unia Czystej i Stosowanej (2009). „jon karboniowy” . IUPAC Kompendium terminologii chemicznej . IUPAC Kompendium terminologii chemicznej . IUPAC. doi : 10.1351/goldbook.C00839 . ISBN 978-0-9678550-9-7 . Źródło 27 listopada 2018 r .
- ^ VL Talrose i AK Lyubimova, Dokl. Akad. Nauk SSSR 86, 909-912 (1952) (po rosyjsku: Тальрозе, В. Л. I А. К. Любимова. ектрометра." ДАН СССР 86 (1952): 909-912)
- ^ Nikołajew, Eugeniusz (1998). „Victor Talrose: uznanie” . Dziennik spektrometrii mas . 33 (6): 499–501. Bibcode : 1998JMSp...33..499N . doi : 10.1002/(SICI)1096-9888(199806)33:6<499::AID-JMS684>3.0.CO;2-C . ISSN 1076-5174 .
- ^ Rasul, Golam; Prakash, GK Surya; Ola, George A. (2011). „Badanie porównawcze hiperkoordynacyjnych jonów karboniowych i ich analogów boru: wyzwanie dla spektroskopistów”. Listy z fizyki chemicznej . 517 (1–3): 1–8. Bibcode : 2011CPL...517....1R . doi : 10.1016/j.cplett.2011.10.020 .
-
^
Schreiner, Peter R.; Kim, Seung-Joon; Schaefer, Henry F.; von Rague Schleyer, Paul (1993). „ CH
+ 5 : Niekończąca się historia czy ostatnie słowo?”. Journal of Chemical Physics . 99 (5): 3716–3720. doi : 10.1063/1.466147 . - ^ Müller, Hendrik; Kutzelnigg, Werner; Noga, Józef; Klopper, Wim (1997). „CH5 +: Historia toczy się dalej. Wyraźnie skorelowane badanie skupień sprzężonych”. Journal of Chemical Physics . 106 (5): 1863. Bibcode : 1997JChPh.106.1863M . doi : 10.1063/1.473340 .
-
^
Biały, Edmund T.; Tang, Jian; Dobra, Takeshi (1999). „ CH
+ 5 : Obserwowane widmo w podczerwieni” . nauka . 284 (5411): 135–7. Bibcode : 1999Sci...284..135W . doi : 10.1126/science.284.5411.135 . PMID 10102811 . -
^
Oskar Asvany, Padma Kumar P; Redlich, Britta; Hegemann, Ilka; Schlemmer, Stephan; Marks, Dominik (2005). „Zrozumienie widma w podczerwieni gołego CH
+ 5 ”. nauka . 309 (5738): 1219-1222. Bibcode : 2005Sci...309.1219A . doi : 10.1126/science.1113729 . PMID 15994376 . S2CID 28745636 . -
^
Huang, Xinchuan; McCoy, Anna B.; Bowman, Joel M .; Johnson, Lindsay M.; Dziki, Chandra; Dong, Feng; Nesbitt, David J. (2006). „Kwantowa dekonstrukcja widma w podczerwieni CH
+ 5 ” . nauka . 311 (5757): 60–63. Bibcode : 2006Sci...311...60H . doi : 10.1126/science.1121166 . PMID 16400143 . S2CID 26158108 . - Bibliografia _ Jost, R. (2000). „Jony karbenu i węgla w aktywacji małych alkanów katalizowanej ciekłym i stałym superkwasem” (PDF) . Chemia czysta i stosowana . 72 (12): 2309–2318. doi : 10.1351/pac200072122309 . S2CID 46627813 .
- ^ a b Pole, FH; Munson, MSB (1965). „Reakcje jonów gazowych. XIV. Badania spektrometrii masowej metanu pod ciśnieniem do 2 torów”. Dziennik Amerykańskiego Towarzystwa Chemicznego . 87 (15): 3289–3294. doi : 10.1021/ja01093a001 .