toksyna PR
|
|

|
|
| Nazwy | |
|---|---|
|
Preferowana nazwa IUPAC
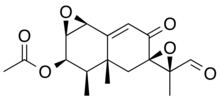
(1a R ,2 R ,2′ R ,3 R ,3′ S ,3a R ,7b S )-3′-Formylo-3,3′,3a-trimetylo-6-okso-1a,2,3a,4 octan ,6,7b-heksahydro-3H - spiro[nafto[1,2- b ]oksireno-5,2′-oksiran]-2-ylu |
|
| Identyfikatory | |
|
Model 3D ( JSmol )
|
|
| 3DMet | |
| CHEBI | |
| CHEMBL | |
| ChemSpider | |
| KEGG | |
|
Identyfikator klienta PubChem
|
|
| UNII | |
|
Pulpit nawigacyjny CompTox ( EPA )
|
|
|
|
|
|
|
O ile nie zaznaczono inaczej, dane podano dla materiałów w stanie normalnym (przy 25°C [77°F], 100 kPa).
|
|
Penicylina Roquefort Toxin ( toksyna PR ) jest mikotoksyną wytwarzaną przez grzyby Penicillium roqueforti . W 1973 roku toksyna PR została po raz pierwszy częściowo scharakteryzowana przez wyizolowanie spleśniałej kukurydzy, na której rosły grzyby. Chociaż jego śmiertelną dawkę określono wkrótce po wyizolowaniu substancji chemicznej, szczegóły jej działania toksycznego nie zostały w pełni wyjaśnione aż do 1982 roku w badaniu na myszach, szczurach, znieczulonych kotach i preparatach z izolowanych małżowin usznych szczurów .
Struktura i reaktywność
Toksyna PR zawiera wiele grup funkcyjnych, w tym grupę acetoksylową (CH3COO- ) , aldehydową (-CHO), α,β-nienasycony keton (-C=C-CO) i dwa epoksydy . Grupa aldehydowa na C-12 jest bezpośrednio zaangażowana w aktywność biologiczną, ponieważ usunięcie prowadzi do inaktywacji związku. Dwie grupy epoksydowe nie odgrywają ważnej roli, ponieważ usunięcie nie wykazało różnicy w aktywności. Pod wpływem powietrza toksyna PR może ulec rozkładowi. Nie wiadomo jednak, jak i dlaczego tak się dzieje.
Synteza
Toksyna PR pochodzi z 15-węglowego węglowodoru arystolochenu , seskwiterpenu wytwarzanego z difosforanu farnezylu, katalizowanego przez enzym syntazę arystolochenu . Aristolochene otrzymuje następnie alkohol, keton i dodatkowy alken, za pośrednictwem oksydazy hydroksysterolowej i oksydoreduktazy chinonowej. [ wymagane wyjaśnienie ] Dodanie skondensowanego tlenu epoksydowego przez monooksygenazę P450 daje eremofortynę B. Epoksydacja izopropenylu łańcuch boczny, ponownie przez monooksygenazę P450, a dodanie grupy acetylowej przez acetylotransferazę daje eremofortynę A. Krótkołańcuchowa oksydoreduktaza utlenia grupę metylową w łańcuchu bocznym do eremofortyny C, pierwszorzędowego alkoholowego analogu toksyny PR (nieprawidłowo zilustrowanego w poniższy diagram), który jest następnie dalej utleniany przez krótkołańcuchową dehydrogenazę alkoholową, dając aldehyd .
Eremofortynę C wyizolowano ze źródeł mikrobiologicznych i stwierdzono, że znajduje się w spontanicznej równowadze między strukturą hydroksyketonu o otwartym łańcuchu a formą laktolu .
Metabolizm
Różne eksperymenty wykazały wpływ toksyny PR na komórki wątroby w hodowli (in vitro) iw wątrobie (in vivo).
in vitro
Toksyna PR spowodowała zahamowanie włączania aminokwasów, wyniki te pokazują, że toksyna była odpowiedzialna za zmianę procesu translacji. Wraz z niektórymi wcześniejszymi eksperymentami udowodniono, że toksyna PR była rzeczywiście aktywna w metabolizmie komórkowym. Innym interesującym odkryciem jest zmniejszona aktywność kontroli oddechowej i fosforylacji oksydacyjnej w (izolowanych) mitochondriach wątroby.
Najwyraźniej ilość polisomów nie była decydującym czynnikiem, hamowanie nie zmniejszało się przez zwiększanie ilości polisomów. Z drugiej strony wzrost enzymów ph5 miał znaczący efekt hamujący. Wyższe stężenie enzymów ph5 zmniejszało skuteczność działania hamującego. Odkrycia te dowiodły, że toksyna PR nie zmienia polisomów, ale w pewien sposób zaburza działanie enzymów ph5.
Na żywo
Gdy toksynę PR podano bezpośrednio szczurom, synteza białek w wątrobie nie była tak wysoka, jak normalnie. To podawanie in vivo wykazało, że wyizolowane komórki z wątroby szczura miały znacznie niższą zdolność transkrypcyjną.
Proces ten nie zmienił wychwytu aminokwasów w wątrobie, ale dotyczył wyłącznie procesu translacji. Toksyczne działanie tej toksyny jest, zgodnie z oczekiwaniami, bliskie zahamowaniu procesu syntezy białek. Jednak prawdziwym efektem toksycznym może być to, że niektóre wymagane białka nie są wytwarzane w odpowiedniej ilości, aby funkcjonowały we właściwy sposób.
Mechanizm akcji
Wiele eksperymentów wykazało różne efekty toksyny PR: może powodować uszkodzenie wątroby i nerek, może wywoływać rakotwórczość i może in vivo hamować replikację DNA, syntezę białek i transkrypcję. [ potrzebne lepsze źródło ] Większość eksperymentów dotyczących wpływu toksyny PR koncentruje się na hamowaniu syntezy białek i upośledzeniu czynności wątroby.
Toksyna PR zaburza proces transkrypcji w wątrobie. Toksyna wpływa na polimerazy RNA I i II, dwa główne układy polimeraz RNA w wątrobie. Toksyna nie wymaga dalszej konwersji enzymatycznej, aby wywierać wpływ na te układy. Wątroba wydaje się być narządem, na który toksyna PR ma największy wpływ.
Toksyczność
Toksyczność toksyny PR mierzono zarówno dootrzewnowo, jak i doustnie. Pierwsza określona średnia śmiertelna dawka czystej toksyny PR dootrzewnowo u odstawionych od matki szczurów wynosiła 11 mg/kg. Średnia śmiertelna dawka doustna wynosiła 115 mg/kg. To samo badanie wykazało, że dziesięć minut po doustnej dawce 160 mg/kg, zwierzęta doświadczały problemów z oddychaniem, które ostatecznie doprowadziły do śmierci.
Ostre badania na szczurach (mg/kg)
- test LDLo drogą doustną: 115
- test LD50 droga dootrzewnowa: 11,6
- test LD50, dożylnie: 8.2
Ostre badania na myszach (mg/kg)
- test LD50 drogą doustną: 72
- test LD50, dootrzewnowo: 2
- test LD50, dożylnie: 2
Nie przeprowadzono jeszcze ostrych badań na ludziach, więc nie są jeszcze znane żadne wyniki testów ani dawki LD50. Istnieje jednak jeden opis przypadku z 1982 r., w którym opisano działanie toksyczne na człowieka. Ta osoba pracowała w fabryce, w której produkowano niebieski ser. Ta osoba wdychała pleśń Penicillium roqueforti i rozwinęła się nadwrażliwość na zapalenie płuc. Z powodu tego zapalenia płuc osoba doświadczała między innymi kaszlu, duszności, zmniejszonej objętości płuc i hipoksemii. Przeciwciała przeciwko pleśni znaleziono później w surowicy i płynie z popłuczyn. Jednak wartości LD50 nie zostały jeszcze określone.
Wpływ na zwierzęta
Badania wpływu na zwierzęta przeprowadzono na myszach, szczurach, znieczulonych kotach i preparatach z izolowanego małżowiny usznej szczura. Działania toksyczne u myszy i szczurów obejmowały skręcanie się brzucha, zmniejszenie aktywności ruchowej i częstości oddechów, osłabienie tylnych nóg i ataksję.
Efekty były różne dla różnych sposobów wchłaniania toksyny PR. Gdy średnia dawka śmiertelna została przyjęta doustnie, patologię opisywano jako obrzęk żołądka i jelit wypełnionych gazem, a także obrzęk i przekrwienie płuc. Nerka wykazała zmiany zwyrodnieniowe oraz krwotok.
Jeśli toksyna PR została wstrzyknięta dootrzewnowo, u kotów, myszy i szczurów rozwinął się płyn puchlinowy oraz obrzęk płuc i moszny. Podczas gdy wstrzyknięcie dożylne wykazało, u tych samych zwierząt, duże objętości opłucnej i osierdzia, jak również obrzęk płuc.
Podsumowując, komórki tkanek i naczynia krwionośne zostały bezpośrednio uszkodzone przez toksynę PR. Spowodowało to wyciek płynu skutkujący m.in. obrzękiem płuc i płynem puchlinowym. Również uszkodzenie naczyń krwionośnych skutkowało zwiększoną przepuszczalnością naczyń włosowatych. Ta zwiększona przepuszczalność prowadzi do zmniejszenia objętości krwi i bezpośredniego uszkodzenia ważnych dla życia narządów, w tym płuc, nerek, wątroby i serca.

