2,4,6-Tri- tert -butylofenol

|
|
| Nazwy | |
|---|---|
|
Preferowana nazwa IUPAC
2,4,6-Tri- tert -butylofenol |
|
| Inne nazwy 2,4,6-TTBP
|
|
| Identyfikatory | |
|
Model 3D ( JSmol )
|
|
| CHEMBL | |
| ChemSpider | |
| Karta informacyjna ECHA | 100.010.900 |
| Numer WE |
|
|
Identyfikator klienta PubChem
|
|
| UNII | |
|
Pulpit nawigacyjny CompTox ( EPA )
|
|
|
|
|
|
| Nieruchomości | |
| C18H30O _ _ _ _ | |
| Masa cząsteczkowa | 262,437 g·mol -1 |
| Zagrożenia | |
| Oznakowanie GHS : | |
 
|
|
| Ostrzeżenie | |
| H302 , H315 , H319 , H410 | |
| P264 , P270 , P273 , P280 , P301+P312 , P302+P352 , P305+P351+P338 , P321 , P330 , P332 + P313 , P337+P313 , P362 , P391 , P501 | |
|
O ile nie zaznaczono inaczej, dane podano dla materiałów w stanie normalnym (przy 25°C [77°F], 100 kPa).
|
|
2,4,6-Tri- tert -butylofenol ( 2,4,6-TTBP ) jest fenolem symetrycznie podstawionym trzema grupami tert -butylowymi , a więc silnie zawadą przestrzenną . 2,4,6-TTBP jest łatwo utleniającym się związkiem aromatycznym i słabym kwasem . Utlenia się dając ciemnoniebieski rodnik 2,4,6-tri- tert -butylofenoksy. 2,4,6-TTBP jest spokrewniony z 2,6-di- tert -butylofenolem , który jest szeroko stosowany jako przeciwutleniacz w zastosowaniach przemysłowych. Związki te są bezbarwnymi ciałami stałymi.
Przygotowanie
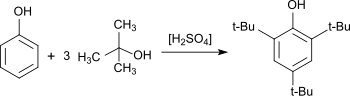
Wytwarzanie 2,4,6-tri-tert-butylofenolu było szeroko badane. Już w 1890 roku Wilhelm Koenigs opisał katalizowaną kwasem reakcję fenolu z izobutylenem . Pojawiło się wiele innych raportów. Zgłaszano wydajność do 90%. Typowe produkty uboczne powstające w wyniku niepełnego alkilowania to: 4- tert -butylofenol (4-TBP), 2,4-di- tert -butylofenol (2,4-DTBP), 2,6-di- tert -butylofenol (2, 6-DTBP). Zaobserwowano 2,5-di- tert -butylofenol (2,5-DTB). 2,4,6-tri- tert -butylofenol występuje również jako produkt uboczny w syntezie produktów podstawienia 2,4-DTBP i 2,6-DTBP, które są szerzej stosowanymi przeciwutleniaczami.
Opisano syntezę 2,4,6-tri- tert -butylofenolu, która jest również odpowiednia jako eksperyment dydaktyczny. Jako środek alkilujący stosuje się eter metylowo-tert-butylowy , a jako katalizator stosuje się kwas siarkowy. 2,4,6-TTBP otrzymuje się z wydajnością 69%.
Nieruchomości
2,4,6-Tri- tert -butylofenol jest białą substancją stałą, która rozpuszcza się w wielu rozpuszczalnikach organicznych, ale nie rozpuszcza się w wodnych lub alkoholowych roztworach alkalicznych. Charakterystyczne dla fenoli zielononiebieskie zabarwienie chlorkiem żelaza(III) nie występuje w 2,4,6-TTBP. Związek jest utlenialny w powietrzu, ale praktycznie nie ulega biodegradacji.
Jako bogaty w elektrony związek aromatyczny, 2,4,6-tri- tert -butylofenol można również łatwo utlenić elektrochemicznie. W środowisku alkalicznym utworzony anion fenolanowy jest najpierw utleniany w odwracalnej reakcji do rodnika fenoksylowego. Stabilny rodnik jest utleniany przez dalsze odciąganie elektronów do kationu fenoksoniowego, który reaguje w wodzie dając 2,4,6-tri- tert -butylo-4-hydroksy-2,5-cykloheksadienon.
W środowisku kwaśnym hydroksydienon ulega dealkilacji z odszczepieniem grupy tert-butylowej w pozycji 4 do 2,6-di- tert -butylohydrochinonu, który jest utleniany do produktu końcowego 2,6-di- tert -butylu -1,4-benzochinon.
Utlenianie 2,4,6-tri- tert -butylofenolu w środowisku alkalicznym do intensywnie niebieskiego rodnika fenoksy może również zachodzić w przypadku żelazicyjanku potasu . Rodnik 2,4,6-tri- tert -butylofenoksy tworzy niebieskie kryształy po ochłodzeniu do -70 °C, które są stabilne w temperaturze pokojowej przez kilka tygodni i dopiero stopniowo żółkną. Rodnik fenoksy reaguje z tlenem jako dwurodnik, tworząc nadtlenek z wiązaniem 4,4', tworząc żółte kryształy.
Aplikacje
Bogaty w elektrony 2,4,6-tri- tert -butylofenol można łatwo utlenić do rodnika fenoksylowego, który w pozycji 4 przyłącza fenole, a także alkohole i tiole do odpowiednich cykloheksadienonów. Cykloheksadienony, określane również w literaturze jako chinoleeter , rozszczepiają grupę tert-butylową w pozycji 4 podczas ogrzewania w warunkach kwasowych i aromatyzują z powrotem do podstawionego fenolu.
Reakcję można wykorzystać do syntezy 2,6-di- tert -butylo-4-metoksyfenolu, który jest często stosowany jako przeciwutleniacz.
2,4,6-TTBP jest stosowany jako stabilizatory , zmiatacze wolnych rodników i przeciwutleniacze w zastosowaniach technicznych, takich jak paliwa , płyny hydrauliczne i oleje smarowe , a także w polimerach elastomerowych i termoplastycznych. Ze względu na swoją wyraźną trwałość , wysoką skłonność do bioakumulacji i toksyczność dla środowiska wodnego , 2,4,6-TTBP ma niewielkie zastosowanie przemysłowe, a nawet jest zabronione, na przykład w Japonii .
Rodnik fenoksylowy 2,4,6-TTBP jest również opisany jako sterycznie wymagająca grupa zabezpieczająca w odczynniku do przenoszenia nukleofilowej grupy dimetyloaminometylowej [(CH3 ) 2 - N-CH2- ] z wytworzeniem trzeciorzędowych amin .