Alfa-laktoalbumina
| LALBA | |||||||||||||||||||||||||||||||||||||||||||||||
|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|
 | |||||||||||||||||||||||||||||||||||||||||||||||
| |||||||||||||||||||||||||||||||||||||||||||||||
| Identyfikatory | |||||||||||||||||||||||||||||||||||||||||||||||
| , entrez:3906, LYZG, lactalbumin alpha, HAMLET | |||||||||||||||||||||||||||||||||||||||||||||||
| Identyfikatory zewnętrzne | |||||||||||||||||||||||||||||||||||||||||||||||
| |||||||||||||||||||||||||||||||||||||||||||||||
| |||||||||||||||||||||||||||||||||||||||||||||||
| |||||||||||||||||||||||||||||||||||||||||||||||
| |||||||||||||||||||||||||||||||||||||||||||||||
| |||||||||||||||||||||||||||||||||||||||||||||||
| Wikidane | |||||||||||||||||||||||||||||||||||||||||||||||
| |||||||||||||||||||||||||||||||||||||||||||||||
Laktalbumina, alfa- , znana również jako LALBA , jest białkiem , które u ludzi jest kodowane przez gen LALBA .
Przegląd
α-laktoalbumina jest białkiem regulującym produkcję laktozy w mleku prawie wszystkich gatunków ssaków . U naczelnych ekspresja alfa-laktoalbuminy jest zwiększona w odpowiedzi na hormon prolaktynę i zwiększa produkcję laktozy .
α-laktoalbumina tworzy podjednostkę regulatorową heterodimeru syntazy laktozy (LS), a β-1,4-galaktozylotransferaza (beta4Gal-T1) tworzy składnik katalityczny. Razem te białka umożliwiają LS wytwarzanie laktozy poprzez przenoszenie ugrupowań galaktozy do glukozy . Jako multimer alfa-laktoalbumina silnie wiąże jony wapnia i cynku i może wykazywać działanie bakteriobójcze lub przeciwnowotworowe. Fałdowany wariant ludzkiej alfa-laktoalbuminy, który może tworzyć się w kwaśnym środowisku, takim jak żołądek, zwany HAMLET , prawdopodobnie indukuje apoptozę w komórkach nowotworowych i niedojrzałych. Odpowiednia dynamika fałdowania alfa-laktoalbuminy jest zatem bardzo niezwykła.
Po utworzeniu kompleksu z Gal-T1 galaktozylotransferaza , α-laktoalbumina, około 1000 razy zwiększa powinowactwo enzymu do glukozy i hamuje zdolność do polimeryzacji wielu jednostek galaktozy . Daje to początek szlakowi tworzenia laktozy poprzez przekształcenie Gal-TI w syntazę laktozy .
Właściwości fizyczne
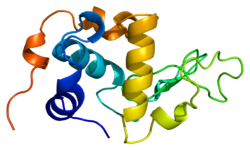
Struktura alfa-laktoalbuminy jest dobrze znana i składa się ze 123 aminokwasów i 4 mostków dwusiarczkowych. Masa cząsteczkowa wynosi 14178 Da, a punkt izoelektryczny wynosi od 4,2 do 4,5. Alfa-laktoalbumina ma dwie wyróżniające się formy: stan holo i stan apo. Stan holo jest formą naturalną – zwiniętą i związaną wapniem. Stan apo występuje w środowisku kwaśnym i jest związany z uwalnianiem jonów wapnia i rozwijaniem beta-kartki. Jedną z głównych różnic strukturalnych w stosunku do beta-laktoglobuliny jest to, że nie ma ona żadnej wolnej grupy tiolowej , która mogłaby służyć jako punkt wyjścia dla reakcji agregacji kowalencyjnej. W rezultacie czysta α-laktoalbumina nie tworzy żeli po denaturacji i zakwaszeniu. Alpha-LA jest białkiem wiążącym Ca2 + z pojedynczym silnym miejscem wiązania wapnia, jak pokazano poniżej. Wapń wiąże się z grupami karboksylowymi trzech reszt asparaginianu (Asp 82, 87, 88), widocznymi na niebiesko oraz z grupami karbonylowymi lizyny 79 i asparaginianu 84, widocznymi na fioletowo. To wiązanie jest koordynowane przez dwie cząsteczki wody (kolor czerwony). Te miejsca wiązania reszt są konserwowane u większości gatunków zawierających alfa-laktalbuminę.
Ewolucja
Porównanie sekwencji α-laktoalbuminy wykazuje silne podobieństwo do sekwencji lizozymów , zwłaszcza c-lizozymu wiążącego Ca2 + . Te dwa białka mają wiele wspólnego z ich strukturą fizyczną, ale zawierają mniej niż połowę tej samej sekwencji aminokwasowej, a zatem drastycznie różnią się pod względem funkcji. Tak więc oczekiwana historia ewolucyjna jest taka, że po duplikacji genu c-lizozymu następowała mutacja, powodująca utratę aktywności katalitycznej lizozymu w alfa-laktoalbuminie. Gen ten poprzedza ostatniego wspólnego przodka ssaków i ptaków, co prawdopodobnie wskazuje na jego pochodzenie około 300 mA.
Funkcje
Obecne badania zmierzają do znalezienia nowych zastosowań alfa-laktoalbuminy poza fizjologiczną produkcją laktozy.
Odżywianie: Alfa-laktoalbumina jest niezbędna w żywieniu noworodków. Białko to dostarcza niezbędnych aminokwasów i związków bioaktywnych niezbędnych do optymalnego wzrostu, rozwoju i zdrowia. Alpha-LA jest najobficiej występującym białkiem serwatki w ludzkim mleku, a jego właściwości zostały zbadane w celu włączenia go do preparatów dla niemowląt w celu replikacji składników mleka matki. Białko to jest silnym źródłem aminokwasów rozgałęzionych , cysteiny i reszt tryptofanu, z których każda ma skorelowane korzyści zdrowotne.
Zastosowania kliniczne: Alfa-laktoalbumina była badana w połączeniu z wieloma różnymi schorzeniami i uważa się, że koreluje z pozytywnymi wynikami. Wiele z tych korzyści wynika ze związków bioaktywnych, z których jest zbudowane, oraz zdolności białka do wiązania kompleksów.
PCOS : Zespół policystycznych jajników (PCOS) to jedna choroba, w której wyższe poziomy alfa-La zostały powiązane z łagodzeniem objawów. Ten stan jest ściśle powiązany z dysbiozą jelit spowodowaną zapaleniem błony śluzowej jelit i brakiem równowagi mikroflory. , takie jak Lactobacillus acidophilus , Bifidobacterium short i Bifidobacterium longum . Bakterie te wytwarzają krótkołańcuchowe kwasy tłuszczowe (SCFA), które poprawiają biom jelit. W kontrolowanym badaniu grupa, która spożywała dietę o wyższej zawartości alfa-laktoalbuminy, doświadczyła zmniejszenia objawów związanych z PCOS i wyższego poziomu zdrowych bakterii. Chociaż nie ma lekarstwa na ten stan, może to być krótkoterminowe lekarstwo.
Zdrowie psychiczne: alfa-laktoalbumina jest źródłem aminokwasów, które są związane z poprawą zdrowia psychicznego. Białko to jest bogate w pozostałości tryptofanu, które są prekursorem serotoniny , neuroprzekaźnika związanego z pozytywnym nastrojem. Białko zwiększa również stężenie w osoczu innych dużych aminokwasów obojętnych (LNAA), które pomagają zrównoważyć hormony. Reszty cysteiny pomagają w syntezie glutationu, który jest ważnym przeciwutleniaczem.
Rak: Przeprowadzono szeroko zakrojone badania nad efektami apoptotycznymi , które alfa-laktoalbumina może mieć, gdy tworzy kompleks z kwasem oleinowym zwanym HAMLET (ludzka alfa-laktoalbumina, która jest śmiertelna dla komórek nowotworowych). Ten HAMLET zaburza strukturę błony po związaniu, promując śmierć komórki w celu ochrony integralności organizmu. Kompleks ten może przemieszczać się do jąder komórek nowotworowych, ale nie do komórek zdrowych. W wielu badaniach wykazano , że w komórkach nowotworowych ten kompleks białko-OA spowalnia postęp nowotworów. Stan natywny alfa-laktoalbuminy nie wykazuje tych samych funkcji przeciwnowotworowych, więc jest prawdopodobne, że kwas oleinowy wyraża funkcje apoptotyczne, podczas gdy alfa-laktoalbumina jest odpowiedzialna za celowanie w określone linie komórkowe, takie jak komórki rakowe okrężnicy, pęcherza moczowego i glioblastoma .
Dalsza lektura
- Heine WE, Klein PD, Reeds PJ (marzec 1991). „Znaczenie alfa-laktoalbuminy w żywieniu niemowląt”. Dziennik żywienia . 121 (3): 277–283. doi : 10.1093/jn/121.3.277 . PMID 2002399 .
- Permyakov EA, Berliner LJ (maj 2000). „alfa-laktoalbumina: struktura i funkcja”. Listy FEBS . 473 (3): 269–274. doi : 10.1016/S0014-5793(00)01546-5 . PMID 10818224 . S2CID 83964232 .
- Hall L, Emery DC, Davies MS, Parker D, Craig RK (marzec 1987). „Organizacja i sekwencja ludzkiego genu alfa-laktalbuminy” . Dziennik biochemiczny . 242 (3): 735–742. doi : 10.1042/bj2420735 . PMC 1147772 . PMID 2954544 .
- Davies MS, West LF, Davis MB, Povey S, Craig RK (lipiec 1987). „Gen dla ludzkiej alfa-laktoalbuminy jest przypisany do chromosomu 12q13”. Annals of Human Genetics . 51 (3): 183–188. doi : 10.1111/j.1469-1809.1987.tb00869.x . PMID 3479943 . S2CID 37901087 .
- Findlay JB, Brew K (maj 1972). „Pełna sekwencja aminokwasowa ludzkiej -laktoalbuminy” . Europejski Dziennik Biochemii . 27 (1): 65–86. doi : 10.1111/j.1432-1033.1972.tb01812.x . PMID 5049057 .
- Hall L, Craig RK, Edbrooke MR, Campbell PN (czerwiec 1982). „Porównanie sekwencji nukleotydów sklonowanego cDNA pre-alfa-laktalbuminy człowieka i świnki morskiej z cDNA pre-lizozymu kurcząt sugeruje ewolucję od wspólnego genu przodków” . Badania kwasów nukleinowych . 10 (11): 3503–3515. doi : 10.1093/nar/10.11.3503 . PMC 320727 . PMID 6285305 .
- Håkansson A, Zhivotovsky B, Orrenius S, Sabharwal H, Svanborg C (sierpień 1995). „Apoptoza indukowana przez białko ludzkiego mleka” . Proceedings of the National Academy of Sciences of the United States of America . 92 (17): 8064–8068. Bibcode : 1995PNAS...92.8064H . doi : 10.1073/pnas.92.17.8064 . PMC41287 . _ PMID 7644538 .
- Stacey A, Schnieke A, Kerr M, Scott A, McKee C, Cottingham I i in. (marzec 1995). „Laktacja jest zakłócona przez niedobór alfa-laktoalbuminy i może zostać przywrócona przez wymianę ludzkiego genu alfa-laktoalbuminy u myszy” . Proceedings of the National Academy of Sciences of the United States of America . 92 (7): 2835–2839. Bibcode : 1995PNAS...92.2835S . doi : 10.1073/pnas.92.7.2835 . PMC42313 . _ PMID 7708733 .
- Fujiwara Y, Miwa M, Takahashi R, Hirabayashi M, Suzuki T, Ueda M (czerwiec 1997). „Niezależna od pozycji i wysoka ekspresja ludzkiej alfa-laktoalbuminy w mleku transgenicznych szczurów niosących DNA YAC o długości 210 kb”. Rozmnażanie i rozwój molekularny . 47 (2): 157–163. doi : 10.1002/(SICI)1098-2795(199706)47:2<157::AID-MRD5>3.0.CO;2-L . PMID 9136116 . S2CID 43232515 .
- Lindner RA, Kapur A, Carver JA (październik 1997). „Interakcja molekularnego białka opiekuńczego, alfa-krystaliny, ze stopionymi stanami kuleczek bydlęcej alfa-laktoalbuminy” . Journal of Biological Chemistry . 272 (44): 27722–27729. doi : 10.1074/jbc.272.44.27722 . PMID 9346914 .
- Giuffrida MG, Cavaletto M, Giunta C, Neuteboom B, Cantisani A, Napolitano L i in. (listopad 1997). „Niezwykły tryplet aminokwasów Asn-Ile-Cys jest konsensusowym miejscem glikozylacji w ludzkiej alfa-laktoalbuminie”. Journal of Protein Chemistry . 16 (8): 747–753. doi : 10.1023/A:1026359715821 . PMID 9365923 . S2CID 42107172 .
- Chandra N, Brew K, Acharya KR (kwiecień 1998). „Strukturalne dowody na obecność drugorzędowego miejsca wiązania wapnia w ludzkiej alfa-laktoalbuminie”. Biochemia . 37 (14): 4767–4772. doi : 10.1021/bi973000t . PMID 9537992 .
- Håkansson A, Andréasson J, Zhivotovsky B, Karpman D, Orrenius S, Svanborg C (luty 1999). „Multimeryczna alfa-laktoalbumina z ludzkiego mleka indukuje apoptozę poprzez bezpośredni wpływ na jądra komórkowe”. Eksperymentalne badania komórkowe . 246 (2): 451–460. doi : 10.1006/excr.1998.4265 . PMID 9925761 .
- Svensson M, Sabharwal H, Håkansson A, Mossberg AK, Lipniunas P, Leffler H, et al. (marzec 1999). „Charakterystyka molekularna wariantów fałdowania alfa-laktoalbuminy, które indukują apoptozę w komórkach nowotworowych” . Journal of Biological Chemistry . 274 (10): 6388–6396. doi : 10.1074/jbc.274.10.6388 . PMID 10037730 .
- Harata K, Abe Y, Muraki M (marzec 1999). „Krystalograficzna ocena wewnętrznego ruchu ludzkiej alfa-laktoalbuminy udoskonalona metodą najmniejszych kwadratów z pełną matrycą”. Dziennik biologii molekularnej . 287 (2): 347–358. doi : 10.1006/jmbi.1999.2598 . PMID 10080897 .
- Ostatnia rano, Schulman BA, Robinson CV, Redfield C (sierpień 2001). „Badanie subtelnych różnic w zachowaniu wymiany wodoru wariantów stopionej globulki ludzkiej alfa-laktoalbuminy za pomocą spektrometrii mas”. Dziennik biologii molekularnej . 311 (4): 909–919. doi : 10.1006/jmbi.2001.4911 . PMID 11518539 .
- Bai P, Peng Z (listopad 2001). „Kooperatywne składanie izolowanej domeny alfa-helikalnej lizozymu białka jaja kurzego”. Dziennik biologii molekularnej . 314 (2): 321–329. doi : 10.1006/jmbi.2001.5122 . PMID 11718563 .
- Andrews P (sierpień 1970). „Oczyszczanie syntetazy laktozy białka z mleka ludzkiego i wykazanie jego interakcji z alfa-laktoalbuminą”. Listy FEBS . 9 (5): 297–300. doi : 10.1016/0014-5793(70)80382-9 . PMID 11947697 . S2CID 23041445 .
Linki zewnętrzne
- alfa-laktoalbumina w US National Library of Medicine Medical Subject Headings (MeSH)
- Lokalizacja ludzkiego genomu LALBA i strona szczegółów genu LALBA w przeglądarce genomu UCSC .