Aromatyczna O-demetylaza cytochromu P450
| Aromatyczna O-demetylaza, podjednostka cytochromu P450 | |||||||
|---|---|---|---|---|---|---|---|
 Struktura krystaliczna gcoA (schemat kreskówkowy) w kompleksie z hemem (zielone kule) i gwajakolem (magenta) na podstawie .
| |||||||
| Identyfikatory | |||||||
| Organizm | |||||||
| Symbol | gcoA | ||||||
| WPB | 5NCB | ||||||
| UniProt | P0DPQ7 | ||||||
| Inne dane | |||||||
| numer WE | 1.14.14.- | ||||||
| |||||||
| Aromatyczna O-demetylaza, podjednostka reduktazy | |||||||
|---|---|---|---|---|---|---|---|
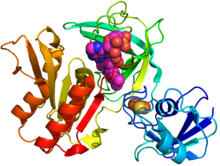 Struktura krystaliczna gcoB (schemat kreskówkowy) skompleksowana z FAD (kulki magenta) i klastrem żelazo-siarka (pomarańczowy / żółty) na podstawie .
| |||||||
| Identyfikatory | |||||||
| Organizm | |||||||
| Symbol | gcoB | ||||||
| WPB | 5OGX | ||||||
| UniProt | P0DPQ8 | ||||||
| Inne dane | |||||||
| numer WE | 1.6.2.- | ||||||
| |||||||
Aromatyczna O-demetylaza cytochromu P450 jest enzymem bakteryjnym , który katalizuje demetylację ligniny i różnych lignoli . Reakcja netto jest zgodna z następującą stechiometrią, zilustrowaną ogólnym metoksyarenem:
- ArOCH 3 + O 2 + 2 e - + 2 H + → ArOH + CH 2 O + H 2 O
Enzym wyróżnia się rozwiązłością, wpływa na O-demetylację szeregu substratów, w tym ligniny.
Jest heterodimerycznym białkiem pochodzącym z produktów dwóch genów. Białka składowe to cytochromu P450 (kodowany przez gen gcoA z rodziny CYP255A) i trójdomenowa reduktaza (kodowana przez gen gcoB) skompleksowana z trzema kofaktorami ( 2Fe-2S , FAD i NADH ).
Mechanizm
GcoA i GcoB tworzą w roztworze kompleks dimeru. GcoA przetwarza substrat, podczas gdy GcoB dostarcza elektrony do obsługi oksydazy o funkcji mieszanej. Podobnie jak w przypadku innych P450, monooksygenacja substratu przebiega równocześnie z redukcją połowy równoważnika O2 do wody. Można założyć mechanizm odbicia tlenu . GcoA umieszcza pierścień aromatyczny w hydrofobowej wnęce miejsca aktywnego, w której znajduje się hem.
Struktura
GcoA ma typową strukturę P450: hem zligowany tiolanem obok zakopanego miejsca aktywnego. GcoB jest jednak niezwykły. Cytochromy P450 są zwykle uzupełniane przez reduktazę cytochromu P450 lub reduktazę ferredoksyny i ferredoksyny; jego elektrony są przenoszone przez NAD+ lub NADP+ . GcoB ma jednak jeden polipeptyd. Ten polipeptyd ma N-końcową ferredoksynę z regionem wiążącym zarówno NAD(P)+, jak i FAD .
CcoA i GcoB są ze sobą ściśle powiązane, działając jako heterodimer w roztworze. Powierzchnia GcoB ma kwaśną plamę, która musi oddziaływać z pasującym regionem zasadowym w GcoA. Zakłada się, że część GcoB oddziałująca z GcoA znajduje się na przecięciu domeny wiążącej FAD i domeny ferredoksyny. Aby to osiągnąć, GcoB musiałby przejść pewne zmiany strukturalne, które reprezentowałyby nową klasę systemów P450 (rodzina N).
Potencjalne aplikacje
Cytochrom P450 aromatyczna O-demetylaza pomaga w częściowej O-demetylacji ligniny. Otrzymane 1,2-diole dobrze nadają się do degradacji oksydacyjnej przez dioksygenazy wewnątrz- i ekstra-diolowe. Tak więc O-demetylowane ligniny są potencjalnie podatne na częściową depolimeryzację. Przy mniejszej liczbie wiązań poprzecznych zmodyfikowany ligand jest potencjalnie bardziej użyteczny niż prekursor, począwszy od paliw


