Syntaza tromboksanu-A
| Identyfikatory | |||||||||||||||||||||||||||||||||||||||||||||||
|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|
| TBXAS1 | |||||||||||||||||||||||||||||||||||||||||||||||
| , BDPLT14, CYP5, CYP5A1, GHOSAL, THAS, TS, TXAS, TXS, syntaza tromboksanu A 1 Identyfikatory | |||||||||||||||||||||||||||||||||||||||||||||||
| zewnętrzne | |||||||||||||||||||||||||||||||||||||||||||||||
| |||||||||||||||||||||||||||||||||||||||||||||||
| |||||||||||||||||||||||||||||||||||||||||||||||
| |||||||||||||||||||||||||||||||||||||||||||||||
| |||||||||||||||||||||||||||||||||||||||||||||||
| |||||||||||||||||||||||||||||||||||||||||||||||
| Wikidane | |||||||||||||||||||||||||||||||||||||||||||||||
| |||||||||||||||||||||||||||||||||||||||||||||||
Syntaza tromboksanu A 1 ( EC 5.3.99.5 , płytka krwi, cytochrom P450, rodzina 5, podrodzina A) , znana również jako TBXAS1 , jest enzymem cytochromu P450 , który u ludzi jest kodowany przez gen TBXAS1 .
Funkcjonować
Ten gen koduje członka nadrodziny enzymów cytochromu P450. Białka cytochromu P450 to monooksygenazy, które katalizują wiele reakcji związanych z metabolizmem leków i syntezą cholesterolu, steroidów i innych lipidów. Jednak białko to jest uważane za członka nadrodziny cytochromu P450 na podstawie podobieństwa sekwencji, a nie podobieństwa funkcjonalnego. To białko błonowe retikulum endoplazmatycznego katalizuje konwersję prostaglandyny H2 do tromboksanu A2 , silnego środka zwężającego naczynia krwionośne i indukującego agregacji płytek krwi , a także kwas 12-hydroksyheptadekatrienowy (tj. kwas 12-( S )-hydroksy-5Z , 8E , 10E - heptadekatrienowy lub 12-HHT ) agonista receptorów leukotrienowych B4 (tj. receptory BLT2 ) i mediator niektóre działania receptora BLT2 . Enzym odgrywa rolę w kilku procesach patofizjologicznych, w tym w hemostazie, chorobach sercowo-naczyniowych i udarze. Gen wyraża dwa warianty transkryptu.
Inhibitory
Inhibitory syntazy tromboksanu są stosowane jako leki przeciwpłytkowe . Ifetroban jest silnym i selektywnym antagonistą receptora tromboksanu. Dipirydamol również antagonizuje ten receptor, ale ma również różne inne mechanizmy działania przeciwpłytkowego. Pikotamid działa zarówno jako inhibitor syntazy tromboksanu, jak i jako antagonista receptora tromboksanu .
Struktura
Ludzka syntaza tromboksanu A (TXA) jest białkiem cytochromu P450 o masie 60 kDa z 533 aminokwasami i hemową grupą prostetyczną . Enzym ten, zakotwiczony w retikulum endoplazmatycznym, znajduje się w płytkach krwi, monocytach i kilku innych typach komórek. Koniec NH2 zawiera dwa segmenty hydrofobowe, których drugorzędową strukturę uważa się za spiralną. Dowody sugerują, że peptydy służą jako kotwica błonowa dla enzymu. Ponadto badanie klonów cDNA, które było możliwe dzięki technikom reakcji łańcuchowej polimerazy, dodatkowo wyjaśniło pierwotną strukturę syntazy TXA. Podobnie jak inni członkowie rodziny cytochromu P450, syntaza TXA ma grupę hemu skoordynowaną z grupą tiolanową reszty cysteiny, w szczególności cysteiny 480. Badania mutagenezy, w których dokonano podstawień w tej pozycji, spowodowały utratę aktywności katalitycznej i minimalne wiązanie hemu. Inne reszty, które dały podobne wyniki to W133, R478, N110 i R413. Znajdujące się w pobliżu grup propionianowych hemu lub dystalnej powierzchni hemu, reszty te są również ważne dla prawidłowej integracji hemu z apoproteiną. Niestety, badaczom trudno było uzyskać strukturę krystaliczną syntazy TXA ze względu na konieczność ekstrakcji detergentem z membrany, ale wykorzystali modelowanie homologiczne do stworzenia struktury 3D. Jeden model wykazał dwie domeny, domenę bogatą w helisę alfa i domenę bogatą w arkusze beta. Stwierdzono, że hem był umieszczony pomiędzy helisami I i L.
Mechanizm
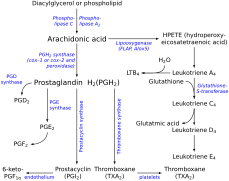
Tromboksan A (TXA) pochodzi z prostaglandyny H2 (PGH2) cząsteczka. PGH2 zawiera stosunkowo słabe wiązanie epidioksy, a znany jest możliwy mechanizm obejmujący homolityczne rozszczepienie epiditlenku i przegrupowanie do TXA. Ważną rolę w tym mechanizmie odgrywa grupa hemowa w miejscu aktywnym syntazy TXA. Badania kinetyki z zatrzymanym przepływem z analogiem substratu i rekombinowaną syntazą TXA ujawniły, że wiązanie substratu zachodzi w dwóch etapach. Najpierw następuje szybkie wstępne wiązanie z białkiem, a następnie ligacja z żelazem hemowym. W pierwszym etapie mechanizmu żelazo hemowe koordynuje się z tlenem endonadtlenku C-9. Uczestniczy w homolitycznym rozszczepianiu wiązania OO w endonadtlenku, co stanowi etap ograniczający szybkość i ulega zmianie stanu redoks z Fe(III) do Fe(IV). Wolny rodnik tlenowy tworzy się przy C-11, a ten związek pośredni ulega rozszczepieniu pierścienia. Gdy wolny rodnik jest teraz w pozycji C-12, hem żelaza utlenia następnie ten rodnik do karbokationu. Cząsteczka jest teraz gotowa do utworzenia pierścienia wewnątrzcząsteczkowego. Ujemnie naładowany tlen atakuje karbonyl, a elektrony z jednego z podwójnych wiązań są przyciągane do karbokationu, zamykając w ten sposób pierścień.
Znaczenie biologiczne
Utrzymanie równowagi między prostacyklinami a tromboksanami jest ważne w organizmie, zwłaszcza że te dwa eikozanoidy wywierają przeciwstawne działanie. Katalizując syntezę tromboksanów, syntaza TXA bierze udział w szlaku przepływu, który może modulować ilość wytwarzanego tromboksanu. Ta kontrola staje się ważnym czynnikiem w kilku procesach, takich jak regulacja ciśnienia krwi, krzepnięcie i reakcje zapalne. Uważa się, że dysregulacja syntazy TXA i brak równowagi w stosunku prostacykliny do tromboksanu leżą u podstaw wielu stanów patologicznych, takich jak nadciśnienie płucne . Ponieważ tromboksany odgrywają rolę w zwężaniu naczyń i agregacji płytek krwi, ich dominacja może zakłócać homeostazę naczyniową i powodować zakrzepowe zdarzenia naczyniowe. Co więcej, znaczenie tromboksanów i ich syntez w homeostazie naczyniowej ilustrują obserwacje, że pacjenci, u których płytki krwi nie reagowały na TXA, wykazywali defekty hemostatyczne, a niedobór produkcji płytek krwi TXA prowadził do zaburzeń krzepnięcia.
Ponadto stwierdzono, że ekspresja syntazy TXA może mieć krytyczne znaczenie dla rozwoju i progresji raka. Ogólny wzrost ekspresji syntazy TXA zaobserwowano w różnych nowotworach, takich jak rak brodawkowaty tarczycy , rak prostaty i rak nerki . Komórki rakowe są znane ze swojego nieograniczonego potencjału replikacji komórkowej i postawiono hipotezę, że zmiany w profilu eikozanoidów wpływają na wzrost raka. Badania doprowadziły do wniosku, że syntaza TXA przyczynia się do szeregu szlaków przeżycia guza, w tym wzrostu, apoptozy hamowanie, angiogeneza i przerzuty .
Ścieżka
Zobacz też
Dalsza lektura
- Shen RF, Tai HH (1998). „Tromboksany: syntaza i receptory”. J. Biomed. nauka . 5 (3): 153–172. doi : 10.1007/BF02253465 . PMID 9678486 .
- Smith G, Stubbins MJ, Harries LW, Wolf CR (1999). „Genetyka molekularna nadrodziny monooksygenazy ludzkiego cytochromu P450”. Ksenobiotyk . 28 (12): 1129–1165. doi : 10.1080/004982598238868 . PMID 9890157 .
- Wang LH, Kulmacz RJ (2003). „Syntaza tromboksanowa: struktura i funkcja białka i genu”. Prostaglandyny Inne media lipidowe . 68-69: 409-422. doi : 10.1016/S0090-6980(02)00045-X . PMID 12432933 .
- Itoh S, Yanagimoto T, Tagawa S i in. (1992). „Organizacja genomowa ludzkiego genu związanego z P-450IIIA7 (cytochrom P-450HFLa) specyficznego dla płodu i interakcja czynnika regulującego transkrypcję z jego elementem DNA w regionie flankującym 5 '”. Biochim. Biofiza. Akta . 1130 (2): 133–8. doi : 10.1016/0167-4781(92)90520-a . PMID 1562592 .
- Yokoyama C, Miyata A, Ihara H i in. (1991). „Klonowanie molekularne ludzkiej płytkowej syntazy tromboksanu A”. Biochem. Biofiza. Rez. Komuna . 178 (3): 1479-1484. doi : 10.1016/0006-291X(91)91060-P . PMID 1714723 .
- Ohashi K, Ruan KH, Kulmacz RJ i in. (1992). „Pierwotna struktura ludzkiej syntazy tromboksanu określona na podstawie sekwencji cDNA” . J. Biol. chemia . 267 (2): 789–93. doi : 10.1016/S0021-9258(18)48353-6 . PMID 1730669 .
- Jones DA, Fitzpatrick FA, Malcolm KC (1991). „Synteza tromboksanu A2 w ludzkich komórkach erytroleukemii”. Biochem. Biofiza. Rez. Komuna . 180 (1): 8–14. doi : 10.1016/S0006-291X(05)81247-1 . PMID 1930241 .
- Wang LH, Ohashi K, Wu KK (1991). „Izolacja częściowego komplementarnego DNA kodującego ludzką syntazę tromboksanu”. Biochem. Biofiza. Rez. Komuna . 177 (1): 286–291. doi : 10.1016/0006-291X(91)91980-Q . PMID 2043115 .
- Nüsing R, Schneider-Voss S, Ullrich V (1990). „Oczyszczanie immunopowinowactwa ludzkiej syntazy tromboksanu”. Łuk. Biochem. Biofiza . 280 (2): 325–330. doi : 10.1016/0003-9861(90)90337-X . PMID 2195994 .
- Mestel F, Oetliker O, Beck E i in. (1980). „Ciężkie krwawienie związane z wadliwą syntetazą tromboksanu” . Lancet . 1 (8160): 157. doi : 10.1016/S0140-6736(80)90642-X . PMID 6101498 . S2CID 29803926 .
- Miyata A, Yokoyama C, Ihara H i in. (1994). „Charakterystyka ludzkiego genu (TBXAS1) kodującego syntazę tromboksanu”. Eur. J. Biochem . 224 (2): 273–279. doi : 10.1111/j.1432-1033.1994.00273.x . PMID 7925341 .
- Wang LH, Tazawa R, Lang AQ, Wu KK (1995). „Alternatywny splicing mRNA ludzkiej syntazy tromboksanowej”. Łuk. Biochem. Biofiza . 315 (2): 273–278. doi : 10.1006/abbi.1994.1500 . PMID 7986068 .
- Maruyama K, Sugano S (1994). „Oligo-capping: prosta metoda zastąpienia struktury czapeczki eukariotycznych mRNA oligorybonukleotydami”. gen . 138 (1–2): 171–174. doi : 10.1016/0378-1119(94)90802-8 . PMID 8125298 .
- Lee KD, Baek SJ, Shen RF (1994). „Klonowanie i charakterystyka ludzkiego promotora genu syntazy tromboksanu”. Biochem. Biofiza. Rez. Komuna . 201 (1): 379–387. doi : 10.1006/bbrc.1994.1712 . PMID 8198598 .
- Chase MB, Baek SJ, Purtell DC i in. (1993). „Mapowanie ludzkiego genu syntazy tromboksanu (TBXAS1) na chromosomie 7q34-q35 za pomocą dwukolorowej fluorescencyjnej hybrydyzacji in situ”. Genomika . 16 (3): 771–773. doi : 10.1006/geno.1993.1264 . PMID 8325653 .
- Ruan KH, Wang LH, Wu KK, Kulmacz RJ (1993). „Topologia amino-końcowa syntazy tromboksanu w retikulum endoplazmatycznym” . J. Biol. chemia . 268 (26): 19483–90. doi : 10.1016/S0021-9258(19)36541-X . PMID 8366093 .
- Tazawa R, zielony ED, Ohashi K i in. (1996). „Charakterystyka pełnej struktury genomowej ludzkiego genu syntazy tromboksanu i analiza funkcjonalna jego promotora”. Łuk. Biochem. Biofiza . 334 (2): 349–356. doi : 10.1006/abbi.1996.0464 . PMID 8900410 .
- Baek SJ, Lee KD, Shen RF (1996). „Struktura genomowa i polimorfizm ludzkiego genu kodującego syntazę tromboksanową”. gen . 173 (2): 251–256. doi : 10.1016/0378-1119(95)00881-0 . PMID 8964509 .
- Suzuki Y, Yoshitomo-Nakagawa K, Maruyama K i in. (1997). „Konstrukcja i charakterystyka biblioteki cDNA wzbogaconej o pełnej długości i wzbogaconej o koniec 5'”. gen . 200 (1–2): 149–156. doi : 10.1016/S0378-1119(97)00411-3 . PMID 9373149 .
Linki zewnętrzne
- Syntaza tromboksanu-A + w National Library of Medicine w USA Nagłówki przedmiotów medycznych (MeSH)