Chemia platyny organicznej
Chemia platyny organicznej to chemia związków metaloorganicznych zawierających wiązanie chemiczne węgiel - platyna oraz badanie platyny jako katalizatora w reakcjach organicznych . Związki platyny organicznej występują na stopniu utlenienia od 0 do IV, przy czym stopień utlenienia II występuje najczęściej. Ogólna kolejność siły wiązania jest następująca: Pt-C (sp) > Pt-O > Pt-N > Pt-C (sp 3 ). Organoplatyna i organopallad chemiczne są podobne, ale związki platyny organicznej są bardziej stabilne, a zatem mniej przydatne jako katalizatory.
Organoplatyna(0)
Większość związków platyny organicznej (0) zawiera ligandy alkenowe i alkinowe. Kompleksy karbonylowe są rzadkie, a analog Ni(CO) 4 jest nieuchwytny. Ligandy alkenowe i alkinowe służą jako donory dwuelektronowe, na przykład w kompleksach (PPh 3 ) 2 Pt (C 2 H 4 ) i (PPh 3 ) 2 Pt ( C 2 Ph 2 ). Ligand etylenu w (PPh 3 ) 2 Pt (C 2 H 4 ) jest nietrwały i wymienia się z alkinami i alkenami elektrofilowymi, nawet C 60 fullerenem .
Ogólną drogą syntezy (PPh 3 ) 2 Pt(un) (un = alken, alkin) jest redukcja tetrachloroplatynianu potasu etanolowym roztworem wodorotlenku potasu lub hydrazyny w obecności ligandu fosfinowego, takiego jak trifenylofosfina i alkenu lub alkinu. Takie reakcje zachodzą za pośrednictwem cis -dichlorobis(trifenylofosfino)platyny(II). Ligandy na bazie azotu często nie wspierają tworzenia kompleksów platyny z alkenami i alkinami.
Zerowartościowe kompleksy platyny organicznej pozbawione ligandów fosfinowych są często przygotowywane przez PtCl2 ( COD).
- Li 2 C 8 H 8 + PtCl 2 (ChZT) + 3 C 7 H 10 → [Pt (C 7 H 10 ) 3 ] + 2 LiCl + C 8 H 8 + C 8 H 12
- Pt (C 7 H 10 ) 3 + 2 ChZT → Pt(ChZT) 2 + 3 do 7 H 10
gdzie C7H10 oznacza norbornen . _ _
Organoplatyna (I)
Związki platyny (I) są rzadkie, ale generalnie są diamagnetyczne, ponieważ mają wiązania Pt-Pt. Przykładem jest dikacja [Pt 2 (CO) 6 ] 2+ .
Organoplatyna (II)
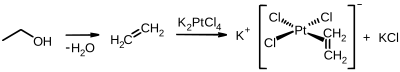
Historycznie znaczącym związkiem platyny organicznej (II) jest sól Zeise'a , którą otrzymuje się z tetrachloroplatynianu etylenu i potasu :
Bezbarwny diolefinowy kompleks dichloro (cyklookta-1,5-dieno) platyny (II) jest bardziej nowoczesnym krewnym i jest szerzej stosowany.
Stabilność i różnorodność alkenowych kompleksów platyny(II) kontrastuje z rzadkością alkenowych kompleksów niklu(II). Powszechne są również kompleksy allilowe platyny. W przeciwieństwie do chemii niklu, gdzie związki takie jak CpNi (L) X są powszechne, cyklopentadienylu Pt (II) są rzadkie, co jest zgodne z niechęcią Pt (II) do przekształcenia się w pentakoordynację.
Kompleksy alkilo- i aryloplatyny(II) są często wytwarzane przez utleniającą addycję halogenku alkilu lub halogenku arylu do prekursora Pt(0), takiego jak tetrakis (trifenylofosfino)platyna(0) lub Pt(C 2H 4 )(PPh 3 ) 2 . Alternatywnie chlorki platyny (II) są podatne na alkilowanie:
- PtCl 2 (SMe 2 ) 2 + 2 MeLi → PtMe 2 (SMe 2 ) 2 + 2 LiCl
Ligandy siarczku dimetylu w PtMe 2 (SMe 2 ) 2 można zastąpić innymi ligandami.
Wiele kompleksów platyny organicznej (II) powstaje w wyniku orto-metalacji i powiązanych procesów aktywacji wewnątrzcząsteczkowej CH.
Organoplatyna (IV)
Pierwszym związkiem platyny organicznej, jaki kiedykolwiek zsyntetyzowano, był jodek trimetyloplatyny z chlorku platyny (IV) i jodku metylomagnezu , opisany przez Pope'a i Peacheya w 1907 r. Związek przyjmuje strukturę podobną do kubanu z czterema potrójnie mostkowymi ligandami jodkowymi. „Tetrametyloplatyna” została ogłoszona w 1952 r. przez Henry'ego Gilmana jako pochodna tego tetrameru, ale później wykazano, że twierdzenie to było błędne („tetrametyloplatyna” okazała się być [PtMe 3 OH] 4 ). Sole [PtMe 6 ] 2− i [PtMe 4 ] 2− zostały scharakteryzowane.
Wodorki platyny organicznej (IV) są rzadkie. Pierwszych izolowanych przedstawicieli przygotowano z halogenków lub kwasów cynoorganicznych z ortometalowanymi związkami aryloplatyny(II). Związek Me(PEt 3 ) 2 PtOTf reaguje odwracalnie z kwasem trifluorometanosulfonowym w temperaturze od -60 do -80 °C, tworząc metan i (PEt 3 ) 2 Pt(OTf) 2 w temperaturze -20 °C. Słabym kwasom często wystarcza nawet woda i alkohol, aw aktywacji wiązania CH źródłem protonu jest alkan.
Kataliza
Katalizatory heterogeniczne na bazie platyny odgrywają główną rolę w przemyśle petrochemicznym i zakłada się, że te użyteczne reakcje zachodzą poprzez związane z powierzchnią związki platynoorganiczne. Lepiej zdefiniowane, ale mniej znaczące komercyjnie są katalizatory homogeniczne na bazie platyny.
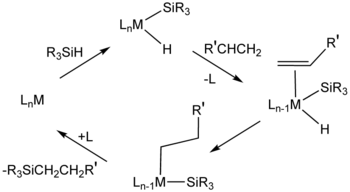
W przypadku hydrosililowania ważnym katalizatorem jest H2PtCl6 ( „ . katalizator Speiera”) Mechanizmy tego układu katalitycznego zwykle zakładają związki pośrednie zawierające wodorek , ligand sililowy (R3Si ) i ligandy alkenowe. Cis-dichlorobis (siarczek dietylu) platyny (II) i katalizator Karstedta (addukt diwinylotetrametylodisiloksanu i kwasu chloroplatynowego ) również katalizują hydrosililowanie . Wiele metalodendrimerów ma powtarzające się jednostki oparte na związkach platyny organicznej.
Tematy badawcze
Związki platyny organicznej biorą udział w systemie Shilova do konwersji metanu w chlorek metylu . Podejmowano usilne wysiłki, jak dotąd bezskutecznie, aby rozszerzyć tę reaktywność na praktyczne metody funkcjonalizacji metanu. Na przykład kompleksy platyny z bipirymidyną katalizują konwersję metanu, tlenu i trójtlenku siarki do wodorosiarczanu metylu .