Chemia fluoroorganiczna

Niektóre ważne związki fluoroorganiczne. A: fluorometan B: izofluran C: a CFC D: an HFC E: kwas triflonowy F: teflon G: PFOS H: fluorouracyl I: fluoksetyna
Chemia fluoroorganiczna opisuje chemię fluoroorganicznych związków organicznych zawierających wiązanie węgiel-fluor . Związki fluoroorganiczne znajdują różnorodne zastosowania , od repelentów oleju i wody po farmaceutyki , czynniki chłodnicze i odczynniki katalityczne . Oprócz tych zastosowań, niektóre związki fluoroorganiczne są zanieczyszczeniami ze względu na ich wkład w zubożenie warstwy ozonowej , globalne ocieplenie , bioakumulacja i toksyczność . Obszar chemii fluoroorganicznych często wymaga specjalnych technik związanych z obchodzeniem się ze środkami fluorującymi.
Wiązanie węgiel-fluor
Fluor ma kilka charakterystycznych różnic w stosunku do wszystkich innych podstawników spotykanych w cząsteczkach organicznych. W rezultacie właściwości fizyczne i chemiczne fluoroorganicznych mogą różnić się od innych fluorowcoorganicznych .
- węgiel -fluor jest jednym z najsilniejszych w chemii organicznej (średnia energia wiązania około 480 kJ/mol). Jest to znacznie silniejsze niż wiązanie węgla z innymi halogenami (średnia energia wiązania np. wiązania C-Cl wynosi około 320 kJ/mol) i jest jednym z powodów, dla których związki fluoroorganiczne mają wysoką stabilność termiczną i chemiczną.
- węgiel -fluor jest stosunkowo krótkie (około 1,4 Å).
- Promień Van der Waalsa podstawnika fluorowego wynosi tylko 1,47 Å, czyli mniej niż w jakimkolwiek innym podstawniku i jest zbliżony do promienia wodoru (1,2 Å). To, wraz z krótką długością wiązania, jest powodem, dla którego w związkach polifluorowanych nie ma naprężenia sterycznego. Jest to kolejny powód ich wysokiej stabilności termicznej. Ponadto podstawniki fluorowe w związkach polifluorowanych skutecznie chronią szkielet węglowy przed możliwymi atakującymi odczynnikami. Jest to kolejny powód wysokiej stabilności chemicznej związków polifluorowanych.
- Fluor ma najwyższą elektroujemność ze wszystkich pierwiastków: 3,98. Powoduje to wysoki moment dipolowy wiązania CF (1,41 D).
- Fluor ma najniższą polaryzowalność ze wszystkich atomów: 0,56 × 10-24 cm 3 . Powoduje to bardzo słabe siły dyspersji między cząsteczkami polifluorowcami i jest przyczyną często obserwowanego obniżenia temperatury wrzenia przy fluorowaniu, jak również jednoczesnej hydrofobowości i lipofobowości związków polifluorowanych, podczas gdy inne związki perhalogenowane są bardziej lipofilowe .
W porównaniu z chlorkami i bromkami arylowymi, fluorki arylowe tworzą odczynniki Grignarda niechętnie. Z drugiej strony fluorki arylu, np. fluoroaniliny i fluorofenole , często skutecznie ulegają podstawieniu nukleofilowemu.
Rodzaje związków fluoroorganicznych
Fluorowęglowodory
Formalnie fluorowęglowodory zawierają tylko węgiel i fluor. Czasami nazywane są perfluorowęglowodorami. Mogą to być gazy, ciecze, woski lub ciała stałe, w zależności od ich masy cząsteczkowej. Najprostszym fluorowęglowodorem jest gazowy tetrafluorometan (CF 4 ). Płyny obejmują perfluorooktan i perfluorodekalinę. Podczas gdy fluorowęglowodory z pojedynczymi wiązaniami są stabilne, nienasycone fluorowęglowodory są bardziej reaktywne, zwłaszcza te z potrójnymi wiązaniami. Fluorowęglowodory są bardziej stabilne chemicznie i termicznie niż węglowodory, co odzwierciedla względną bezwładność wiązania CF. Są również stosunkowo lipofobowe . Ze względu na zmniejszone międzycząsteczkowe interakcje van der Waalsa , związki na bazie fluorowęglowodorów są czasami stosowane jako smary lub są bardzo lotne. Płyny fluorowęglowe mają zastosowania medyczne jako nośniki tlenu.
Struktura związków fluoroorganicznych może być charakterystyczna. Jak pokazano poniżej, perfluorowane związki alifatyczne mają tendencję do oddzielania się od węglowodorów. Ten efekt „podobne rozpuszcza podobne” jest związany z przydatnością faz fluorowych i wykorzystaniem PFOA w przetwarzaniu fluoropolimerów. W przeciwieństwie do pochodnych alifatycznych, pochodne perfluoroaromatyczne mają tendencję do tworzenia faz mieszanych z niefluorowanymi związkami aromatycznymi, co wynika z interakcji donor-akceptor między układami pi.
Fluoropolimery
Polimerowe związki fluoroorganiczne są liczne i mają znaczenie komercyjne. Obejmują one gatunki całkowicie fluorowane, np. PTFE, do częściowo fluorowanych, np. polifluorek winylidenu ([CH 2 CF 2 ] n ) i polichlorotrifluoroetylen ([CFClCF 2 ] n ). Fluoropolimer politetrafluoroetylenu (PTFE/teflon) jest ciałem stałym.
wodorofluorowęglowodory
Fluorowęglowodory (HFC), związki organiczne zawierające atomy fluoru i wodoru, są najczęstszym rodzajem związków fluoroorganicznych. Są powszechnie stosowane w klimatyzacji i jako czynniki chłodnicze zamiast starszych chlorofluorowęglowodorów , takich jak R-12 i wodorochlorofluorowęglowodorów, takich jak R-21 . Nie szkodzą warstwie ozonowej tak bardzo, jak związki, które zastępują; jednak przyczyniają się do globalnego ocieplenia . Ich stężenie w atmosferze i udział w antropogenicznych gazach cieplarnianych emisje gwałtownie rosną, powodując międzynarodowe zaniepokojenie ich wymuszaniem radiacyjnym .
Fluorowęglowodory z kilkoma wiązaniami CF zachowują się podobnie do macierzystych węglowodorów, ale ich reaktywność może być znacznie zmieniona. Na przykład zarówno uracyl , jak i 5-fluorouracyl są bezbarwnymi, wysokotopliwymi krystalicznymi ciałami stałymi, ale ten ostatni jest silnym lekiem przeciwnowotworowym. Zastosowanie wiązania CF w farmaceutykach opiera się na tej zmienionej reaktywności. Kilka leków i agrochemikaliów zawiera tylko jedno centrum fluoru lub jedną grupę trifluorometylową .
W przeciwieństwie do innych gazów cieplarnianych w porozumieniu paryskim , wodorofluorowęglowodory podlegają innym międzynarodowym negocjacjom.
We wrześniu 2016 r. w tzw. Deklaracji Nowojorskiej wezwano do globalnego ograniczenia stosowania HFC. W dniu 15 października 2016 r., ze względu na wpływ tych chemikaliów na zmiany klimatu , negocjatorzy ze 197 krajów spotkali się na szczycie Programu Narodów Zjednoczonych ds. Protokół montrealski .
Fluorokarbeny
Jak wskazano w tym artykule, podstawniki fluorowe prowadzą do reaktywności, która znacznie różni się od klasycznej chemii organicznej. Najlepszym przykładem jest difluorokarben CF 2 , który jest singletem , podczas gdy karben (CH 2 ) ma trypletowy stan podstawowy. Ta różnica jest znacząca, ponieważ difluorokarben jest prekursorem tetrafluoroetylenu .
Związki perfluorowane
Związki perfluorowane są pochodnymi fluorowęglowodorów, ponieważ są strukturalnie blisko spokrewnione z fluorowęglowodorami. Jednak posiadają również nowe atomy, takie jak azot , jod lub grupy jonowe, takie jak perfluorowane kwasy karboksylowe .
Metody otrzymywania wiązań C-F
Związki fluoroorganiczne wytwarza się wieloma drogami, w zależności od stopnia i regiochemii poszukiwanego fluorowania oraz charakteru prekursorów. Bezpośrednie fluorowanie węglowodorów za pomocą F 2 , często rozcieńczonego N 2 , jest przydatne w przypadku związków wysoko fluorowanych:
-
R
3 CH + F
2 → R
3 CF + HF
Takie reakcje są jednak często nieselektywne i wymagają ostrożności, ponieważ węglowodory mogą w sposób niekontrolowany „spalać się” w F
2 , analogicznie do spalania węglowodorów w O
2 . Z tego powodu opracowano alternatywne metodologie fluorowania. Generalnie metody te dzielą się na dwie klasy.
Fluorowanie elektrofilowe
Fluorowanie elektrofilowe opiera się na źródłach „F + ”. Często takie odczynniki zawierają wiązania NF, na przykład F-TEDA-BF 4 . Asymetryczne fluorowanie, w którym tylko jeden z dwóch możliwych produktów enancjomerycznych jest generowany z prochiralnego substratu, opiera się na elektrofilowych odczynnikach fluorujących. Ilustracją tego podejścia jest przygotowanie prekursora środków przeciwzapalnych:
Metody elektrosyntezy
Specjalna, ale ważna metoda elektrofilowego fluorowania obejmuje elektrosyntezę . Metodę stosuje się głównie do perfluorowania, czyli zastępowania wszystkich wiązań C–H wiązaniami C–F. Węglowodór rozpuszcza się lub zawiesza w ciekłym HF, a mieszaninę poddaje się elektrolizie pod napięciem 5–6 V przy użyciu anod Ni . Metodę po raz pierwszy zademonstrowano przy wytwarzaniu perfluoropirydyny ( C
5 F
5 N ) z pirydyny ( C
5 H
5 N ). Opisano kilka odmian tej techniki, w tym użycie stopionego wodorofluorku potasu lub rozpuszczalników organicznych .
Fluorowanie nukleofilowe
Główną alternatywą dla fluorowania elektrofilowego jest oczywiście fluorowanie nukleofilowe przy użyciu odczynników, które są źródłem „F- ” , dla wypierania nukleofilowego , zwykle chlorku i bromku. Reakcje metatezy z udziałem fluorków metali alkalicznych są najprostsze. W przypadku związków alifatycznych jest to czasami nazywane reakcją Finkelsteina , podczas gdy w przypadku związków aromatycznych jest znane jako proces Halexa .
-
R3CCl
K Cs + MF → R3CF
) , + MCl (M = Na,
Monofluorki alkilowe można otrzymać z alkoholi i odczynnika Olah (fluorek pirydyniowy) lub innych środków fluorujących.
Rozkład tetrafluoroboranów arylodiazoniowych w reakcjach Sandmeyera lub Schiemanna wykorzystuje fluoroborany jako źródła F- .
-
ArN
2 BF
4 → Ar F + N
2 + BF
3
Chociaż fluorowodór może wydawać się mało prawdopodobnym nukleofilem, jest najczęstszym źródłem fluoru w syntezie związków fluoroorganicznych. Takie reakcje są często katalizowane przez fluorki metali, takie jak trifluorek chromu. 1,1,1,2-Tetrafluoroetan , zamiennik CFC, jest wytwarzany przemysłowo przy użyciu następującego podejścia:
- Cl 2 C=CClH + 4 HF → F 3 CCFH 2 + 3 HCl
Zauważ, że ta transformacja pociąga za sobą dwa rodzaje reakcji, metatezę (zastąpienie Cl − przez F − ) i fluorowodorowanie alkenu .
Deoksofluoracja
Środki deoksofluorujące powodują zastąpienie grup hydroksylowych i karbonylowych odpowiednio jednym i dwoma fluorkami. Jednym z takich odczynników, przydatnych dla fluorków do wymiany tlenków w związkach karbonylowych, jest tetrafluorek siarki :
- RCO 2 H + SF 4 → RCF 3 + SO 2 + HF
Alternatywy dla SF4 obejmują trifluorek dietyloaminosiarki (DAST, NEt2SF3 ) i trifluorek bis(2- metoksyetylo )aminosiarki (deokso-fluor). Te odczynniki organiczne są łatwiejsze w obsłudze i bardziej selektywne:
Z fluorowanych bloków budulcowych
Wiele związków fluoroorganicznych powstaje z odczynników dostarczających grupy perfluoroalkilowe i perfluoroarylowe. Na przykład (trifluorometylo)trimetylosilan, CF3Si ( CH3 ) 3 , stosuje się jako źródło grupy trifluorometylowej . Wśród dostępnych fluorowanych bloków budulcowych są CF 3 X (X = Br, I), C 6 F 5 Br i C 3 F 7 I. Gatunki te tworzą odczynniki Grignarda , które następnie można traktować różnymi elektrofilami . Rozwój technologii fluorowych (patrz poniżej, rozpuszczalniki) prowadzi do opracowania odczynników do wprowadzania „ogonów fluorowych”.
Szczególnym, ale znaczącym zastosowaniem podejścia opartego na fluorowanych blokach budulcowych jest synteza tetrafluoroetylenu , który jest wytwarzany przemysłowo na dużą skalę za pośrednictwem difluorokarbenu. Proces rozpoczyna się od termicznego (600-800°C) odchlorowodorowania chlorodifluorometanu :
- CHClF 2 → CF 2 + HCl
- 2 CF 2 → C 2 F 4
Fluorodichlorooctan sodu (nr CAS 2837-90-3) jest używany do wytwarzania chlorofluorokarbenu do cyklopropanacji.
18 F-Metody dostawy
Przydatność radiofarmaceutyków zawierających fluor w 18 -pozytonowej tomografii emisyjnej zmotywowała do opracowania nowych metod tworzenia wiązań C-F. Ze względu na krótki okres półtrwania 18 F syntezy te muszą być bardzo wydajne, szybkie i łatwe. Ilustracją metod jest wytwarzanie glukozy modyfikowanej fluorkami przez zastąpienie triflatu przez znakowany fluorek nukleofilowy:
Rola biologiczna
Biologicznie zsyntetyzowane fluoroorganiczne zostały znalezione w mikroorganizmach i roślinach, ale nie w zwierzętach. Najczęstszym przykładem jest fluorooctan, który występuje jako środek obronny roślin przed roślinożercami w co najmniej 40 roślinach w Australii, Brazylii i Afryce. Inne syntetyzowane biologicznie fluoroorganiczne kwasy tłuszczowe ω-fluoro , fluoroaceton i 2-fluorocytrynian , które uważa się za biosyntetyzowane w szlakach biochemicznych z pośredniego fluoroacetaldehydu. Syntaza fluorku adenozylu jest enzymem zdolnym do biologicznej syntezy wiązania węgiel-fluor. Tworzone przez człowieka wiązania węgiel-fluor są powszechnie spotykane w farmaceutykach i agrochemikaliach , ponieważ zwiększają stabilność szkieletu węglowego; również stosunkowo mały rozmiar fluoru jest wygodny, ponieważ fluor działa jako przybliżony bioizoster wodoru. Wprowadzenie wiązania węgiel-fluor do związków organicznych jest głównym wyzwaniem dla chemików medycznych stosujących chemię fluoroorganicznych, ponieważ wiązanie węgiel-fluor zwiększa prawdopodobieństwo uzyskania skutecznego leku około dziesięciokrotnie. Szacuje się, że 20% farmaceutyków i 30–40% agrochemikaliów to fluoroorganiczne, w tym kilka najlepszych leków. Przykłady obejmują 5-fluorouracyl , fluoksetynę (Prozac), paroksetynę (Paxil), cyprofloksacynę (Cipro), meflochinę i flukonazol .
Aplikacje
Chemia fluoroorganicznych wpływa na wiele dziedzin życia codziennego i technologii. Wiązanie CF znajduje się między innymi w farmaceutykach , agrochemikaliach , fluoropolimerach , czynnikach chłodniczych , środkach powierzchniowo czynnych , środkach znieczulających , repelentach olejowych , katalitycznych i hydrofobowych .
Farmaceutyki i agrochemikalia
Wiązanie węgiel-fluor jest powszechnie spotykane w farmaceutykach i agrochemikaliach, ponieważ jest ogólnie stabilne metabolicznie, a fluor działa jako bioizoster atomu wodoru . Szacuje się, że 1/5 farmaceutyków zawiera fluor, w tym kilka najlepszych leków. Przykłady obejmują 5-fluorouracyl , flunitrazepam (Rohypnol), fluoksetynę (Prozac), paroksetynę (Paxil), cyprofloksacynę (Cipro), meflochinę i flukonazol . Etery podstawione fluorem są lotnymi środkami znieczulającymi , w tym produktami handlowymi metoksyfluranem , enfluranem , izofluranem , sewofluranem i desfluranem . Fluorowęglowodorowe środki znieczulające zmniejszają ryzyko zapalenia w przypadku eteru dietylowego i cyklopropanu . Perfluorowane alkany są stosowane jako substytuty krwi .
Propelent do inhalatora
Fluorowęglowodory są również stosowane jako propelent w inhalatorach z odmierzaną dawką, używanych do podawania niektórych leków na astmę. Obecna generacja propelentów składa się z hydrofluoroalkanów (HFA), które zastąpiły CFC . Inhalatory CFC zostały zakazane od 2008 roku w ramach protokołu montrealskiego ze względu na obawy dotyczące środowiska związane z warstwą ozonową. Inhalatory z propelentem HFA, takie jak FloVent i ProAir ( Salbutamol ), nie mają dostępnych wersji generycznych od października 2014 r.
Fluorosurfaktanty
Fluorosurfaktanty, które mają polifluorowany „ogon” i hydrofilową „głowę”, służą jako środki powierzchniowo czynne , ponieważ koncentrują się na granicy faz ciecz-powietrze ze względu na ich lipofobowość . Fluorosurfaktanty mają niskie energie powierzchniowe i znacznie niższe napięcie powierzchniowe. Fluorosurfaktanty, kwas perfluorooktanosulfonowy (PFOS) i kwas perfluorooktanowy (PFOA) to dwa najczęściej badane ze względu na ich wszechobecność, toksyczność i długi czas przebywania u ludzi i dzikich zwierząt.
Rozpuszczalniki
Związki fluorowe często wykazują różne właściwości rozpuszczalności. Dichlorodifluorometan i chlorodifluorometan były kiedyś szeroko stosowanymi czynnikami chłodniczymi. CFC mają silny niszczenia warstwy ozonowej ze względu na homolityczne rozszczepianie wiązań węgiel-chlor; ich użycie jest w dużej mierze zabronione przez Protokół montrealski . Wodorofluorowęglowodory (HFC), takie jak tetrafluoroetan , służą jako zamienniki CFC, ponieważ nie katalizują zubożenia warstwy ozonowej. Tlen wykazuje wysoką rozpuszczalność w związkach perfluorowęglowodorowych, co przekłada się na ich lipofilowość. Wykazano, że perfluorodekalina zastępuje krew w transporcie tlenu do płuc.
Rozpuszczalnik 1,1,1,2-tetrafluoroetan był używany do ekstrakcji produktów naturalnych, takich jak taksol , olej z wiesiołka i wanilina . 2,2,2-trifluoroetanol jest polarnym rozpuszczalnikiem odpornym na utlenianie.
Odczynniki fluoroorganiczne
Rozwój chemii fluoroorganicznych przyczynił się do powstania wielu odczynników o wartości wykraczającej poza chemię fluoroorganiczną. Kwas trifluorooctowy (CF 3 SO 3 H) i kwas trifluorooctowy (CF 3 CO 2 H) są przydatne w całej syntezie organicznej . Ich silną kwasowość przypisuje się elektroujemności grupy trifluorometylowej , która stabilizuje ładunek ujemny. Grupa triflatowa (sprzężona zasada kwasu trifluorometanosulfonowego) jest dobrą grupą opuszczającą w reakcjach podstawienia.
Fazy fluorowe
Tematem aktualnego zainteresowania w obszarze „zielonej chemii” jest to, że wysoko fluorowane podstawniki, np. perfluoroheksyl (C6F13 ) nadają cząsteczkom charakterystyczne właściwości rozpuszczalności, co ułatwia oczyszczanie produktów w syntezie organicznej . Obszar ten, określany jako „ fluoru ”, wykorzystuje koncepcję podobnych rozpuszczalności w tym sensie, że związki bogate w fluor rozpuszczają się preferencyjnie w rozpuszczalnikach bogatych w fluor. Ze względu na względną obojętność wiązania CF, takie fazy fluorowe są kompatybilne nawet z ostrymi odczynnikami. Ten motyw zrodził techniki „fluorous tagowania”. i ochrona przed fluorem . Ilustracją technologii fluoru jest zastosowanie do redukcji wodorków cyny podstawionych fluoroalkilem, przy czym produkty można łatwo oddzielić od zużytego odczynnika cyny przez ekstrakcję rozpuszczalnikami fluorowanymi.
Hydrofobowe fluorowane ciecze jonowe , takie jak organiczne sole bistriflimidu lub heksafluorofosforanu , mogą tworzyć fazy nierozpuszczalne zarówno w wodzie, jak iw rozpuszczalnikach organicznych, tworząc ciecze wielofazowe .
Ligandy fluoroorganiczne w chemii metali przejściowych
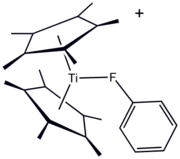
Ligandy fluoroorganiczne są od dawna stosowane w chemii metaloorganicznej i koordynacyjnej . Jedną z zalet ligandów zawierających F jest wygoda 19 F NMR do monitorowania reakcji. Związki fluoroorganiczne mogą służyć jako „ligand donorowy sigma ” , co ilustruje pochodna tytanu(III) [( C5Me5 ) 2Ti ( FC6H5 ) ] BPh4 . Najczęściej jednak podstawniki fluorowęglowe stosuje się w celu zwiększenia kwasowości Lewisa centrów metalowych. Doskonałym przykładem jest „ Eufod ”, kompleks koordynacyjny europu(III), który zawiera ligand acetyloacetonianowy modyfikowany perfluoroheptylem . Ten i pokrewne gatunki są przydatne w syntezie organicznej i jako „odczynniki przesuwające” w spektroskopii NMR .
W obszarze, w którym chemia koordynacyjna i materiałoznawstwo nakładają się na siebie, fluorowanie ligandów organicznych jest wykorzystywane do dostrajania właściwości cząsteczek składowych. Na przykład stopień i regiochemia fluorowania metalowanych ligandów 2-fenylopirydynowych w kompleksach platyny(II) znacząco modyfikuje właściwości emisyjne kompleksów.
Chemia koordynacyjna ligandów fluoroorganicznych obejmuje również technologie fluorowe. Na przykład trifenylofosfina została zmodyfikowana przez przyłączenie podstawników perfluoroalkilowych, które nadają rozpuszczalność w perfluoroheksanie , jak również w nadkrytycznym dwutlenku węgla . Jako konkretny przykład , [ ( C8F17C3H6-4 - C6H4 ) 3P . _ _ _
Aktywacja wiązania CF
Aktywny obszar chemii metaloorganicznej obejmuje rozrywanie wiązań CF przez odczynniki na bazie metali przejściowych. Opracowano zarówno reakcje stechiometryczne, jak i katalityczne, które są interesujące z perspektywy syntezy organicznej i remediacji ksenochemikaliów. Aktywacja wiązania CF została sklasyfikowana w następujący sposób: „(i) utleniające dodanie fluorowęglowodoru, (ii) tworzenie wiązania M – C z eliminacją HF, (iii) tworzenie wiązania M – C z eliminacją fluorosilanu, (iv) hydrodefluorowanie fluorowęglowodoru z tworzeniem wiązań M – F, (v) atak nukleofilowy na fluorowęglowodór i (vi) odfluorowanie fluorowęglowodoru”. Ilustracyjną reakcją aktywacji CF za pośrednictwem metalu jest odfluorowanie fluoroheksanu przez diwodorek cyrkonu , analog odczynnika Schwartza :
- (C 5 Me 5 ) 2 ZrH 2 + 1-FC 6 H 13 → (C 5 Me 5 ) 2 ZrH (F) + C 6 H 14
Aniony fluorowęglowodorów w katalizie Zieglera-Natty
Związki zawierające fluor często występują w niekoordynujących lub słabo koordynujących anionach. Zarówno tetrakis(pentafluorofenylo)boran, B(C6F5 ) 4- , jak i pokrewny tetrakis[3,5-bis(trifluorometylo)fenylo]boran są przydatne w katalizie Zieglera-Natty i pokrewnych metodologiach polimeryzacji alkenów . Podstawniki fluorowane powodują, że aniony stają się słabo zasadowe i zwiększają rozpuszczalność w słabo zasadowych rozpuszczalnikach, które są kompatybilne z mocnymi kwasami Lewisa.
Inżynieria materiałowa
Związki fluoroorganiczne mają wiele niszowych zastosowań w materiałoznawstwie . Dzięki niskiemu współczynnikowi tarcia płynne fluoropolimery są stosowane jako smary specjalne. Smary na bazie fluorowęglowodorów są stosowane w wymagających zastosowaniach. Reprezentatywne produkty to Fomblin i Krytox , wyprodukowane odpowiednio przez Solvay Solexis i DuPont . Niektóre smary do broni palnej, takie jak „Tetra Gun”, zawierają fluorowęglowodory. Wykorzystując ich niepalność, fluorowęglowodory są stosowane w pianie gaśniczej. Związki fluoroorganiczne są składnikami wyświetlaczy ciekłokrystalicznych . Polimerowy analog kwasu trifluorometanosulfonowego, nafion , jest stałym kwasem, który jest używany jako membrana w większości niskotemperaturowych ogniw paliwowych . Dwufunkcyjny monomer 4,4'-difluorobenzofenon jest prekursorem polimerów klasy PEEK .
Biosynteza związków fluoroorganicznych
W przeciwieństwie do wielu naturalnie występujących związków organicznych zawierających cięższe halogenki , chlorki, bromki i jodki, znanych jest tylko kilka biologicznie syntetyzowanych wiązań węgiel-fluor. Najbardziej powszechnym naturalnym związkiem fluoroorganicznym jest fluorooctan , toksyna występująca w kilku gatunkach roślin. Inne obejmują kwas fluorooleinowy, fluoroaceton , nukleocydynę (4'-fuoro-5'-O-sulfamoiladenozynę), fluorotreoninę i 2-fluorocytrynian . Kilka z tych gatunków jest prawdopodobnie biosyntetyzowanych z fluoroacetaldehydu . The enzym fluorynaza katalizował syntezę 5'-dezoksy-5'-fluoroadenozyny (patrz schemat po prawej).
Historia
Chemia fluoroorganiczna rozpoczęła się w XIX wieku wraz z rozwojem chemii organicznej. Pierwsze związki fluoroorganiczne przygotowano przy użyciu trifluorku antymonu jako źródła F- . Niepalność i nietoksyczność chlorofluorowęglowodorów CCl 3 F i CCl 2 F 2 przyciągnęła uwagę przemysłu w latach dwudziestych XX wieku. 6 kwietnia 1938 roku Roy J. Plunkett , młody chemik pracujący w Jackson Laboratory w Deepwater w stanie New Jersey , przypadkowo odkrył politetrafluoroetylen (PTFE). Późniejsze ważne wydarzenia, zwłaszcza w Stanach Zjednoczonych, korzystały z wiedzy zdobytej w produkcji sześciofluorku uranu. Począwszy od późnych lat czterdziestych XX wieku wprowadzono szereg metod elektrofilowego fluorowania, poczynając od CoF 3 . Ogłoszono fluorowanie elektrochemiczne („ elektrofluorowanie ”), które Joseph H. Simons opracował w latach trzydziestych XX wieku w celu wytworzenia wysoce stabilnych materiałów perfluorowanych kompatybilnych z sześciofluorkiem uranu . Te nowe metodologie umożliwiły syntezę wiązań CF bez użycia pierwiastkowego fluoru i bez polegania na metodach metatetycznych.
W 1957 roku opisano działanie przeciwnowotworowe 5-fluorouracylu. Raport ten dostarczył jednego z pierwszych przykładów racjonalnego projektowania leków. Odkrycie to wywołało wzrost zainteresowania fluorowanymi farmaceutykami i agrochemikaliami. Odkrycie związków gazu szlachetnego , np. XeF 4 , dostarczyło wielu nowych odczynników począwszy od wczesnych lat 60. XX wieku. W latach siedemdziesiątych fluorodeoksyglukoza została uznana za użyteczny odczynnik w pozytonowej tomografii emisyjnej 18 F . W pracy nagrodzonej Nagrodą Nobla wykazano, że CFC przyczyniają się do zubożenia ozonu atmosferycznego. Odkrycie to zaalarmowało świat o negatywnych konsekwencjach związków fluoroorganicznych i zmotywowało do opracowania nowych dróg do związków fluoroorganicznych. opisano pierwszy enzym tworzący wiązanie CF, fluorynazę .
Kwestie środowiskowe i zdrowotne
Tylko kilka związków fluoroorganicznych jest silnie bioaktywnych i wysoce toksycznych, takich jak fluorooctan i perfluoroizobuten.
Niektóre związki fluoroorganiczne stwarzają znaczne ryzyko i zagrożenia dla zdrowia i środowiska. CFC i HCFC ( wodorochlorofluorowęglowodory ) niszczą warstwę ozonową i są silnymi gazami cieplarnianymi . HFC są silnymi gazami cieplarnianymi i stoją w obliczu wezwań do zaostrzenia międzynarodowych regulacji i harmonogramów wycofywania jako szybko działającego środka redukcji emisji gazów cieplarnianych, podobnie jak perfluorowęglowodory (PFC) i sześciofluorek siarki (SF 6 ).
Ze względu na wpływ związku na klimat, główne gospodarki grupy G-20 zgodziły się w 2013 r. na wspieranie inicjatyw mających na celu stopniowe wycofywanie się z użycia HCFC. Potwierdzili rolę Protokołu montrealskiego i Ramowej konwencji Narodów Zjednoczonych w sprawie zmian klimatu w globalnym rozliczaniu i redukcji HCFC. Stany Zjednoczone i Chiny jednocześnie ogłosiły dwustronną umowę o podobnym skutku.
Trwałość i bioakumulacja
Ze względu na siłę wiązania węgiel-fluor wiele syntetycznych fluorowęglowodorów i związków na bazie fluorowęglowodorów jest trwałych w środowisku. Fluorosurfaktanty, takie jak PFOS i PFOA , są trwałymi zanieczyszczeniami globalnymi. CFC na bazie fluorowęglowodorów i tetrafluorometan odnotowano w skałach magmowych i metamorficznych . PFOS jest trwałym zanieczyszczeniem organicznym i może szkodzić zdrowiu dzikich zwierząt; potencjalne skutki zdrowotne PFOA dla ludzi są badane przez panel naukowy C8.