odczynnik Schwartza

|
|
|
|
| Nazwy | |
|---|---|
|
nazwa IUPAC
Chloridohydrydocyrkonocen
|
|
|
Systematyczna nazwa IUPAC
chloridobis(η 5 -cyklopentadienylo)hydrydocyrkon |
|
| Inne nazwy Cp 2 ZrClH, wodorek chlorku cyrkonocenu
|
|
| Identyfikatory | |
|
Model 3D ( JSmol )
|
|
| ChemSpider | |
| Karta informacyjna ECHA | 100.048.599 |
| Numer WE |
|
|
Identyfikator klienta PubChem
|
|
| UNII | |
|
Pulpit nawigacyjny CompTox ( EPA )
|
|
|
|
|
|
| Nieruchomości | |
| C10H11ClZr _ _ _ _ | |
| Masa cząsteczkowa | 257,87 g/mol |
| Wygląd | Białe ciało stałe |
| Zagrożenia | |
| Oznakowanie GHS : | |
 
|
|
| Niebezpieczeństwo | |
| H228 , H261 , H314 | |
| P210 , P231+P232 , P240 , P241 , P260 , P264 , P280 , P301+P330+P331 , P303+P361+P353 , P304 +P340 , P305+P351+P338 , P310 , P321 , P363 , P370 + P378 , P402 + P404 , P405 , P501 | |
|
O ile nie zaznaczono inaczej, dane podano dla materiałów w stanie normalnym (przy 25°C [77°F], 100 kPa).
|
|
Odczynnik Schwartza to popularna nazwa związku cyrkonu o wzorze (C 5 H 5 ) 2 ZrHCl, czasami nazywana chlorowodorkiem cyrkonocenu lub wodorkiem chlorku cyrkonu , i nosi imię Jeffreya Schwartza, profesora chemii na Uniwersytecie Princeton . Ten metalocen jest używany w syntezie organicznej do różnych przemian alkenów i alkinów .
Przygotowanie
Kompleks został po raz pierwszy przygotowany przez Wailesa i Weigolda. Można go kupić lub łatwo wytworzyć przez redukcję dichlorku cyrkonocenu wodorkiem litowo-glinowym :
- (C 5 H 5 ) 2 ZrCl 2 + 1 ⁄ 4 LiAlH 4 → (C 5 H 5 ) 2 ZrHCl + 1 ⁄ 4 LiAlCl 4
Ta reakcja daje również (C5H5 ) 2ZrH2 , który traktuje się chlorkiem metylenu , otrzymując odczynnik Schwartza LiAl(Ot-Bu) 3H , który można zastosować zamiast LiAlH4 .
Opisano również alternatywną procedurę, która wygenerowała odczynnik Schwartza z diwodorku. Ponadto możliwe jest wykonanie in situ przygotowania (C 5 H 5 ) 2 ZrHCl z dichlorku cyrkonocenu przy użyciu LiH. Metodę tę można również zastosować do syntezy cząsteczek znakowanych izotopowo, takich jak olefiny, przez zastosowanie Li2H lub Li3H jako środków redukujących.
Odczynnik Schwartza ma niską rozpuszczalność w typowych rozpuszczalnikach organicznych. Trifluorometanosulfonian (C5H5 ) 2ZrH ( OTf) jest rozpuszczalny w THF .
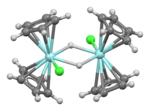
Struktura
Kompleks przyjmuje typową strukturę „clam-shell” obserwowaną dla innych kompleksów Cp2MXn . Struktura dimetaliczna została potwierdzona metodą dyfrakcji elektronów mikrokrystalicznych . Wyniki są zgodne z spektroskopią FT-IR , która wykazała, że wodorki tworzą mostki. Spektroskopia NMR w stanie stałym również wskazuje na strukturę dimeryczną. Rentgenowska struktura krystalograficzna związku metylowego (C 5 H 5 ) 4 Zr 2 H 2 (CH 3 ) 2 związek jest analogiczny.
Zastosowania w syntezie organicznej
Odczynnik Schwartza redukuje amidy do aldehydów .
Możliwym zastosowaniem odczynnika Schwartza jest winylowanie ketonów z dużą wydajnością.
Odczynnik Schwartza był używany w syntezie niektórych antybiotyków makrolidowych , (-) -motuporyny i środków przeciwnowotworowych.
Hydrocyrkonowanie
Hydrocyrkonowanie jest formą hydrometalacji . Substratami do hydrocyrkonowania są alkeny i alkiny . W przypadku końcowych alkinów powstaje głównie końcowy produkt winylocyrkonowy. Reakcje wtórne to addycje nukleofilowe , transmetalacje , addycje koniugatów , reakcje sprzęgania , karbonylowanie i fluorowcowanie .
Badania obliczeniowe wskazują, że hydrocyrkonowanie zachodzi z części wewnętrznej. Po potraktowaniu jednym równoważnikiem Cp2ZrClH , difenyloacetylen daje odpowiedni alkenylocyrkon w postaci mieszaniny izomerów cis i trans . Z dwoma równoważnikami wodorku produktem końcowym była mieszanina erytro i treocyrkonowych :
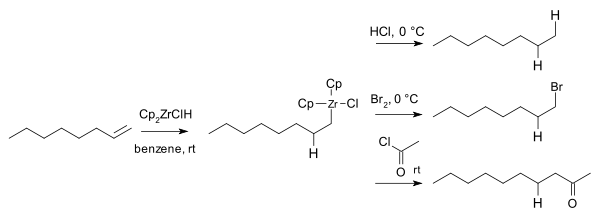
W 1974 Hart i Schwartz poinformowali, że półprodukty cyrkonu reagują z elektrofilami , takimi jak kwas chlorowodorowy , brom i chlorki kwasowe , dając odpowiednie alkany , bromoalkany i ketony :
Odpowiednie związki boroorganiczne i glinoorganiczne były już znane, ale są one wrażliwe na powietrze i/lub piroforyczne , podczas gdy związki cyrkonu nie.
Zakres
W jednym badaniu zwykła regioselektywność hydrocyrkonowania alkinu jest odwracana po dodaniu chlorku cynku :
Jeden przykład hydrocyrkonowania - karbonylowania - sprzęgania w jednym naczyniu przedstawiono poniżej:
W przypadku niektórych alkoholi allilowych grupa alkoholowa jest zastępowana nukleofilowym węglem tworzącym pierścień cyklopropanu : Szczegółowo zbadano selektywność hydrocyrkonowania alkinów. Ogólnie rzecz biorąc, dodanie Zr – H odbywa się poprzez syn . Szybkość dodawania do nienasyconych wiązań węgiel-węgiel to końcowy alkin > końcowy alken ≈ wewnętrzny alkin > dipodstawiony alken acylowe można wytworzyć przez wstawienie CO w wiązanie C-Zr powstałe w wyniku hydrocyrkonowania. Po wstawieniu alkenu do wiązania wodorku cyrkonu, powstały alkil cyrkonu ulega łatwemu przegrupowaniu do końcowego alkilu i dlatego w ten sposób można syntetyzować tylko końcowe związki acylowe. Przegrupowanie najprawdopodobniej przebiega poprzez eliminację β-wodorków, po której następuje ponowne wstawienie.
Dalsza lektura
- Hart, DW; Schwartz, J. (1974). „Hydrocyrkonowanie. Synteza organiczna poprzez półprodukty cyrkonu organicznego. Synteza i przegrupowanie kompleksów alkilocyrkonu (IV) i ich reakcja z elektrofilami”. J. Am. chemia soc. 96 (26): 8115–8116. doi : 10.1021/ja00833a048 .
- Schwartz, J.; Labinger, JA (2003). „Hydrocyrkonowanie: nowy odczynnik metalu przejściowego do syntezy organicznej”. Angew. chemia Int. wyd. 15 (6): 330–340. doi : 10.1002/anie.197603331 .
- Hart, Donald W.; Blackburn, Thomas F.; Schwartz, Jeffrey (1975). „Hydrocyrkonowanie. III. Stereospecyficzna i regioselektywna funkcjonalizacja alkiloacetylenów przez półprodukty winylocyrkonowe (IV)”. J. Am. chemia soc. 97 (3): 679–680. doi : 10.1021/ja00836a056 .
Linki zewnętrzne
- Przykłady w syntezie organicznej na stronie internetowej University of Connecticut