Chlorek metylomagnezu
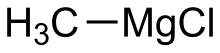
|
|
| Nazwy | |
|---|---|
|
nazwa IUPAC
chlorek(metylo)magnez
|
|
| Inne nazwy (chloromagnezjo)metan
|
|
| Identyfikatory | |
|
Model 3D ( JSmol )
|
|
| CHEBI | |
| ChemSpider | |
| Karta informacyjna ECHA | 100.010.573 |
| Numer WE |
|
|
Identyfikator klienta PubChem
|
|
| UNII |
|
|
Pulpit nawigacyjny CompTox ( EPA )
|
|
|
|
|
|
| Nieruchomości | |
| CH3MgCl _ _ | |
| Masa cząsteczkowa | 74,79 g/mol |
| Wygląd | bezbarwne ciało stałe |
| Reaguje z wodą | |
| Rozpuszczalność | rozpuszczalny w eterze dietylowym i THF |
| Zagrożenia | |
| Bezpieczeństwo i higiena pracy (BHP): | |
|
Główne zagrożenia
|
Produkt łatwopalny, Reaguje z wodą |
| Oznakowanie GHS : | |
 
|
|
| Niebezpieczeństwo | |
| H225 , H250 , H260 , H314 | |
| P210 , P222 , P223 , P231+P232 , P233 , P240 , P241 , P242 , P243 , P260 , P264 , P280 , P301+P330+P331 , P302+P334 , P303 + P361 + P353 , P3 04+P340 , P305 + P351+ P338 , P310 , P321 , P335+P334 , P363 , P370+P378 , P402+P404 , P403+P235 , P405 , P422 , P501 | |
| NFPA 704 (ognisty diament) | |
| Punkt zapłonu | -17 ° C (1 ° F; 256 K) |
| Związki pokrewne | |
|
Związki pokrewne
|
bromek fenylomagnezu , dibutylomagnez |
|
O ile nie zaznaczono inaczej, dane podano dla materiałów w stanie normalnym (przy 25°C [77°F], 100 kPa).
|
|
Chlorek metylomagnezu jest związkiem metaloorganicznym o ogólnym wzorze CH3MgCl . Ten wysoce łatwopalny, bezbarwny i wrażliwy na wilgoć materiał jest najprostszym odczynnikiem Grignarda i jest dostępny w handlu, zwykle jako roztwór w tetrahydrofuranie .
Synteza i reakcje
W porównaniu z częściej spotykanymi bromkami metylomagnezowymi i jodkami metylomagnezowymi, chlorek metylomagnezowy ma zalety związane z niską masą równoważnikową i niskimi kosztami. Otrzymuje się go w reakcji chlorku metylu i magnezu w eterze etylowym .
Podobnie jak w przypadku większości odczynników Grignarda, chlorek metylomagnezu jest silnie solwatowany przez rozpuszczalniki eterowe poprzez koordynację dwóch atomów tlenu, dając centrum magnezu związane z tetraedrycznymi wiązaniami .
Podobnie jak metylolit , jest syntetycznym odpowiednikiem syntonu karbanionu metylu . Reaguje z wodą i innymi odczynnikami protonowymi dając metan, np.:
- CH 3 MgCl + ROH → CH 4 + MgCl(OR)
Po potraktowaniu dioksanem roztwory eterowe chlorku metylomagnezu reagują dając nierozpuszczalny polimer koordynacyjny o wzorze MgCl 2 (dioksan) 2 . W roztworze pozostaje addukt dioksanu z dimetylomagnezem . Ta konwersja wykorzystuje równowagę Schlenka , która jest przesuwana w prawo przez wytrącanie halogenku magnezu:
- 2 CH 3 MgCl + 2 dioksan → (CH 3 ) 2 Mg + MgCl 2 (dioksan) 2
Zobacz też
Dalsza lektura
- Sakai, Shogo; Jordania, KD (1982). „Badanie Ab initio struktury i częstotliwości drgań chlorku metylomagnezu odczynnika Grignarda”. Dziennik Amerykańskiego Towarzystwa Chemicznego . 104 (14): 4019. doi : 10.1021/ja00378a047 .
-
^
Raymond Paul, Olivier Riobe, Michel Maumy (1976). „(E) -4-heksen-1-ol”. Org. Syntezator. 55 : 62. doi : 10.15227/orgsyn.055.0062 .
{{ cite journal }}: CS1 maint: używa parametru autorów ( link ) - ^ ER Coburn (1947). „3-Penten-2-ol”. Org. Syntezator. 27 : 65. doi : 10.15227/orgsyn.027.0065 .
- ^ Fischer, Reinald; Gorls, Helmar; Meisinger, Philippe R.; Suxdorf, Regina; Westerhausen, Matthias (2019). „Zależność struktura-rozpuszczalność kompleksów 1,4-dioksanu di (hydrokarbylo) magnezu” . Chemia - Dziennik Europejski . 25 (55): 12830–12841. doi : 10.1002/chem.201903120 . PMC 7027550 . PMID 31328293 .

