EDDS

|
|
| Nazwy | |
|---|---|
|
nazwa IUPAC
Kwas etylenodiamino- N , N′ -dibursztynowy [ potrzebne źródło ]
|
|
| Identyfikatory | |
|
Model 3D ( JSmol )
|
|
| ChemSpider | |
| Siatka | N,N'-etylenodiamina+kwas dibursztynowy |
|
Identyfikator klienta PubChem
|
|
| UNII | |
|
Pulpit nawigacyjny CompTox ( EPA )
|
|
|
|
|
|
| Nieruchomości | |
| C10H16N2O8 _ _ _ _ _ _ _ | |
| Masa cząsteczkowa | 292,244 g · mol -1 |
| Gęstość | 1,44 g ml -1 |
| Temperatura topnienia | 220 do 222 ° C (428 do 432 ° F; 493 do 495 K) |
| Kwasowość ( p Ka ) | 2.4 |
| Zasadowość (p K b ) | 11.6 |
| Termochemia | |
|
Standardowa entalpia formowania (Δ f H ⦵ 298 ) |
−1,9541–−1,9463 MJ mol −1 |
|
Standardowa entalpia spalania (Δ c H ⦵ 298 ) |
−4,2755–−4,2677 MJ mol −1 |
| Związki pokrewne | |
|
Powiązane kwasy alkanowe
|
EDTA |
|
O ile nie zaznaczono inaczej, dane podano dla materiałów w stanie normalnym (przy 25°C [77°F], 100 kPa).
|
|
Kwas etylenodiamino- N , N' -dibursztynowy ( EDDS ) jest kwasem aminopolikarboksylowym . Jest to bezbarwna substancja stała stosowana jako środek chelatujący , który może stanowić biodegradowalną alternatywę dla EDTA , który jest obecnie stosowany na dużą skalę w wielu zastosowaniach.
Struktura i właściwości
EDDS ma dwa centra chiralne i jako takie trzy stereoizomery. Są to enancjomeryczne (R,R) i (S,S) oraz achiralny izomer mezo (R,S). Jako biodegradowalny zamiennik EDTA interesujący jest tylko stereoizomer (S,S). Stereoizomery (R,S) i (R,R) są mniej biodegradowalne, podczas gdy wykazano, że stereoizomer (S,S) jest bardzo skutecznie biodegradowalny nawet w silnie zanieczyszczonych glebach.
Synteza
EDDS został po raz pierwszy zsyntetyzowany z kwasu maleinowego i etylenodiaminy . Niektóre mikroorganizmy zostały zmanipulowane w celu syntezy (S, S) -EDDS na skalę przemysłową z etylenodiaminy i kwasu fumarowego lub kwasu maleinowego, która przebiega w następujący sposób:
Z kwasu asparaginowego
(S,S)-EDDS jest wytwarzany stereospecyficznie przez alkilowanie dibromku etylenu kwasem L-asparaginowym . Racemiczny EDDS jest wytwarzany w reakcji etylenodiaminy z kwasem fumarowym lub kwasem maleinowym.
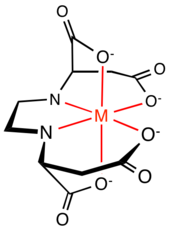
Chemia koordynacyjna
Porównując skuteczność (S,S)-EDDS w porównaniu z EDTA jako czynników chelatujących żelazo (III) :
| Reakcja formacji | Stała formacji |
| [Fe(H 2 O) 6 ] 3+ + (S,S)-EDDS 4− → Fe[(S,S)-EDDS] − + 6 H 2O | KEDDS = 10 20,6 |
| [Fe(H 2 O) 6 ] 3+ + EDTA 4− → Fe(EDTA) − + 6 H 2 O | K EDTA = 10 25,1 |
Ze względu na niższą stabilność [Fe(S,S)-EDDS] - , użyteczny zakres to w przybliżeniu 3< pH (S,S)-EDDS <9 i 2<pH EDTA <11. Zakres ten jest jednak wystarczający dla większości zastosowań.
Innym porównaniem, którego można dokonać pomiędzy (S,S)-EDDS i EDTA jest struktura kompleksu chelatowego. Sześć miejsc donorowych EDTA tworzy pięć pięcioczłonowych pierścieni chelatowych wokół jonu metalu, cztery pierścienie NC 2 OFe i jeden pierścień C 2 N 2 Fe. Pierścień C2N2Fe i dwa pierścienie NC2OFe wyznaczają płaszczyznę symetrii , a dwa pierścienie NC2OFe są prostopadłe do płaszczyzny zawierającej oś C2 . Pięcioczłonowe pierścienie są lekko naprężone. Sześć miejsc donorowych EDDS tworzy zarówno pięcio-, jak i sześcioczłonowe pierścienie chelatowe wokół jonu metalu: dwa pierścienie NC 2 OFe, dwa pierścienie NC 3 OFe i jeden pierścień C 2 N 2 Fe. Badania struktury krystalicznej kompleksu Fe[(S,S)-EDDS] - pokazują, że dwa pięcioczłonowe pierścienie NC 3 OFe wystają poza płaszczyznę kompleksu, zmniejszając naprężenie pierścienia równikowego występujące w Fe[ EDTA] − złożony. Kompleks ma również C2 .
Używa
(S,S)-EDDS to biodegradowalny środek chelatujący stanowiący alternatywę dla EDTA, którego rocznie produkuje się 80 milionów kilogramów. Stwierdzono, że w warunkach naturalnych EDTA przekształca się w kwas etylenodiaminotrioctowy, a następnie cyklizuje do diketopiperazyny , która gromadzi się w środowisku jako trwałe zanieczyszczenie organiczne . (S,S)-EDDS został opracowany komercyjnie jako biodegradowalny chelator i środek stabilizujący w preparatach detergentowych i kosmetycznych. Gdy EDDS stosuje się w nadmiernych przypadkach w wspomaganej chemicznie rekultywacji gleby (np. gdy jest stosowany do przemywania gleby ex situ), można osiągnąć wyższą wydajność ekstrakcji metali ciężkich, a wielkość ekstrakcji jest mniej niezależna od dawki EDDS; Z drugiej strony, podczas rekultywacji gleby, która polega na ciągłym spłukiwaniu, wydobycie metalu jest często ograniczone przez ilość EDDS. W warunkach niedoboru EDDS obserwowano początkową nieselektywną ekstrakcję metali ciężkich, a następnie wymianę metali ciężkich i resorpcję metali ciężkich, które mają niższą stałą stabilności z EDDS.