Fosfataza lekkich łańcuchów miozyny
| Fosfataza lekkiego łańcucha miozyny | |||||||||
|---|---|---|---|---|---|---|---|---|---|
 Struktura kompleksu między PP1 a częścią MYPT1, wygenerowana z
| |||||||||
| identyfikatorów 1s70 | |||||||||
| nr WE | 3.1.3.53 | ||||||||
| nr CAS | 86417-96-1 | ||||||||
| Bazy danych | |||||||||
| IntEnz | Widok IntEnz | ||||||||
| BRENDA | Wpis BRENDY | ||||||||
| ExPASy | Widok NiceZyme | ||||||||
| KEGG | Wpis KEGG | ||||||||
| MetaCyc | szlak metaboliczny | ||||||||
| PRYM | profil | ||||||||
| Struktury PDB | RCSB PDB PDBe PDB suma | ||||||||
| Ontologia genów | AmiGO / QuickGO | ||||||||
| |||||||||
Fosfataza łańcucha lekkiego miozyny , zwana także fosfatazą miozyny ( EC 3.1.3.53 ; nazwa systematyczna [łańcuch lekki miozyny] -fosfohydrolaza fosforanowa ), jest enzymem (konkretnie fosfatazą białkową specyficzną dla serynowo / treoninową ), który defosforyluje regulatorowy łańcuch lekki miozyny II :
- [łańcuch lekki miozyny] fosforan + H2O = [łańcuch lekki miozyny] + fosforan
Ta reakcja defosforylacji zachodzi w tkance mięśni gładkich i inicjuje proces relaksacji komórek mięśniowych. W ten sposób fosfataza miozynowa cofa skurczu mięśni zapoczątkowany przez kinazę łańcucha lekkiego miozyny . Enzym składa się z trzech podjednostek: regionu katalitycznego ( fosfataza białkowa 1 lub PP1), podjednostki wiążącej miozynę (MYPT1) i trzeciej podjednostki (M20) o nieznanej funkcji. Region katalityczny wykorzystuje dwa mangan jony jako katalizatory defosforylacji łańcuchów lekkich miozyny, co powoduje zmianę konformacyjną miozyny i rozluźnienie mięśni. Enzym ten jest wysoce konserwatywny i znajduje się w tkance mięśni gładkich wszystkich organizmów. Chociaż wiadomo, że fosfataza miozynowa jest regulowana przez kinazy białkowe związane z rho , obecnie toczy się debata na temat tego, czy inne cząsteczki, takie jak kwas arachidonowy i cAMP , również regulują ten enzym.
Funkcjonować
Tkanka mięśni gładkich składa się głównie z aktyny i miozyny, dwóch białek, które oddziałują ze sobą, powodując skurcz i rozkurcz mięśni. Miozyna II, znana również jako konwencjonalna miozyna, ma dwa łańcuchy ciężkie, które składają się z domen głowy i ogona oraz cztery łańcuchy lekkie (po dwa na głowę), które wiążą się z łańcuchami ciężkimi w regionie „szyi”. Kiedy mięsień musi się skurczyć, wapnia wpływają do cytozolu z retikulum sarkoplazmatycznego , gdzie aktywują kalmodulinę, która z kolei aktywuje kinazę łańcucha lekkiego miozyny (kinaza MLC). Kinaza MLC fosforyluje łańcuch lekki miozyny (MLC20 ) w reszcie Ser-19. Ta fosforylacja powoduje zmianę konformacyjną miozyny, aktywując cykl mostka krzyżowego i powodując skurcz mięśnia. Ponieważ miozyna przechodzi zmianę konformacyjną, mięsień pozostanie skurczony, nawet jeśli stężenie wapnia i aktywowanej kinazy MLC zostanie doprowadzone do normalnego poziomu. Zmiana konformacyjna musi zostać cofnięta, aby rozluźnić mięsień.
Kiedy fosfataza miozynowa wiąże się z miozyną, usuwa grupę fosforanową . Bez grupy miozyna powraca do swojej pierwotnej konformacji, w której nie może oddziaływać z aktyną i utrzymywać napięcia mięśni, więc mięsień się rozluźnia. Mięsień pozostanie w tej rozluźnionej pozycji, dopóki miozyna nie zostanie fosforylowana przez kinazę MLC i nie ulegnie zmianie konformacyjnej.
Struktura
Fosfataza miozynowa składa się z trzech podjednostek. Podjednostka katalityczna, PP1, jest jedną z ważniejszych fosfataz Ser/Thr w komórkach eukariotycznych , ponieważ odgrywa rolę w metabolizmie glikogenu , transporcie wewnątrzkomórkowym, syntezie białek i podziale komórek a także skurcze mięśni gładkich. Ponieważ jest tak ważny dla podstawowych funkcji komórkowych i ponieważ w komórkach jest znacznie mniej fosfataz białkowych niż kinaz, struktura i funkcja PP1 jest wysoce konserwatywna (chociaż specyficzną izoformą stosowaną w fosfatazie miozyny jest izoforma δ, PP1δ). PP1 działa przy użyciu dwóch jonów manganu jako katalizatorów defosforylacji (patrz poniżej).
Wokół tych jonów znajduje się szczelina w kształcie litery Y z trzema rowkami: hydrofobowym, kwaśnym i C-końcowym. Kiedy PP1 nie jest związany z żadną inną podjednostką, nie jest szczególnie specyficzny. Jednakże, gdy wiąże się z drugą podjednostką fosfatazy miozynowej, MYPT1 (masa cząsteczkowa ~ 130 kDa), ta katalityczna szczelina zmienia konfigurację. Powoduje to dramatyczny wzrost specyficzności miozyny. Jest zatem jasne, że MYPT1 ma wielką moc regulacyjną w stosunku do PP1 i fosfatazy miozynowej, nawet bez obecności innych aktywatorów lub inhibitorów.
Trzecia podjednostka, M20 (nie mylić z MLC20 , krytyczną regulatorową podjednostką miozyny), jest najmniejszą i najbardziej tajemniczą podjednostką. Obecnie niewiele wiadomo o M20, poza tym, że nie jest konieczna do katalizy, ponieważ usunięcie podjednostki nie wpływa na obrót ani selektywność. Chociaż niektórzy uważają, że może pełnić funkcję regulacyjną, nic nie zostało jeszcze ustalone.
Mechanizm
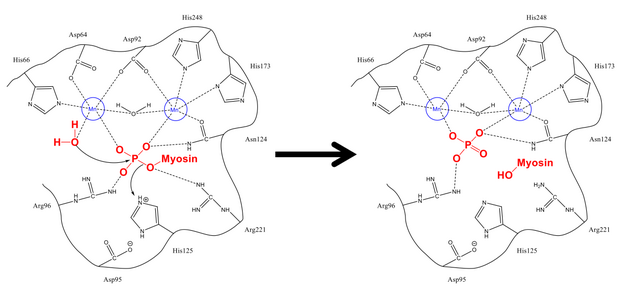
Mechanizm usuwania fosforanu z Ser-19 jest bardzo podobny do innych reakcji defosforylacji w komórce, takich jak aktywacja syntazy glikogenu . Podjednostka regulatorowa miozyny MLC 20 wiąże się zarówno z hydrofobowymi, jak i kwaśnymi rowkami PP1 i MYPT1, miejscem regulatorowym fosfatazy miozyny. Po uzyskaniu odpowiedniej konfiguracji, zarówno seryna fiosforylowana i wolna cząsteczka wody są stabilizowane przez reszty wiążące wodór w miejscu aktywnym, jak również dodatnio naładowane jony (które silnie oddziałują z ujemną grupą fosforanową). His-125 (na fosfatazie miozynowej) przekazuje proton Ser-19 MLC20 ) , a cząsteczka wody atakuje atom fosforu . Po przetasowaniu protonów w celu ustabilizowania się (co dzieje się szybko w porównaniu z atakiem na fosfor), powstają fosforany i alkohol, które opuszczają miejsce aktywne.
Regulacje prawne i zdrowie ludzkie
Szlaki regulacyjne kinazy MLC zostały dobrze poznane, ale do późnych lat 80. zakładano, że fosfataza miozynowa nie jest regulowana, a skurcz/relaksacja była całkowicie zależna od aktywności kinazy MLC. Jednak od lat 80. odkryto i dokładnie zbadano hamujący wpływ kinazy białkowej związanej z rho. RhoA GTP aktywuje kinazę Rho , która fosforyluje MYPT1 w dwóch głównych miejscach hamowania, Thr-696 i Thr-866. To w pełni pokazuje wartość MYPT1, nie tylko dla zwiększenia szybkości reakcji i specyficzności, ale także dla znacznego spowolnienia reakcji. Jednak kiedy telokin skutecznie znosi działanie kinazy Rho, mimo że nie defosforyluje MYPT1.
Inna proponowana strategia regulacyjna dotyczy kwasu arachidonowego. Kiedy kwas arachidonowy jest dodawany do napiętej tkanki mięśniowej, kwas zmniejsza szybkość defosforylacji (a tym samym relaksacji) miozyny. Jednak nie jest jasne, w jaki sposób kwas arachidonowy działa jako inhibitor . Dwie konkurujące ze sobą teorie głoszą, że albo kwas arachidonowy działa jako ko-posłaniec we wspomnianej powyżej kaskadzie kinazy rho, albo wiąże się z c-końcem MYPT1.
Kiedy systemy regulacyjne fosfatazy miozynowej zaczynają zawodzić, mogą wystąpić poważne konsekwencje zdrowotne. Ponieważ mięśnie gładkie znajdują się w układzie oddechowym, krwionośnym i rozrodczym ludzi (jak również w innych miejscach), jeśli mięśnie gładkie nie mogą się już rozluźnić z powodu wadliwej regulacji, wówczas pojawia się wiele problemów, począwszy od astmy , nadciśnienia i mogą wystąpić zaburzenia erekcji .
Zobacz też
Dalsza lektura
- Pato MD, Adelstein RS (1983). „Oczyszczanie i charakterystyka wielopodjednostkowej fosfatazy z mięśnia gładkiego żołądka indyczego. Wpływ wiązania kalmoduliny z kinazą łańcucha lekkiego miozyny na defosforylację” . J. Biol. chemia . 258 (11): 7047–54. doi : 10.1016/S0021-9258(18)32330-5 . PMID 6304072 .
- Kimura K; i in. (1996). „Regulacja fosfatazy miozyny przez kinazę Rho i związaną z Rho (kinaza Rho)”. nauka . 273 (5272): 245–248. Bibcode : 1996Sci...273..245K . doi : 10.1126/science.273.5272.245 . PMID 8662509 . S2CID 37249779 .