Leishmania major
|
|
| Leishmania major | |
|---|---|
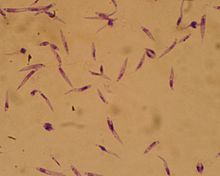
| Promastigoty z Leishmania major , 10×100, barwnik Giemsa. | |
| Klasyfikacja naukowa | |
| Gromada: | Euglenozoa |
| Klasa: | kinetoplastyka |
| Zamówienie: | trypanosomatyda |
| Rodzaj: | Leiszmania |
| Gatunek: |
L. major
|
| Nazwa dwumianowa | |
|
Leishmania major Jakimow i Szochor, 1914
|
|
Leishmania major to gatunek pasożyta występujący w rodzaju Leishmania i jest związany z chorobą odzwierzęcą skórną leiszmaniozą (znaną również jako wrzód Aleppo , wrzód bagdadzki , wrzód zatoki , guzik Biskra , wrzód Chiclero , wrzód Delhi , wrzód Kandahar , wrzód Lahore , orientalny ból , Pian bois i Uta ). L. major jest wewnątrzkomórkowym patogenem atakującym makrofagi i komórki dendrytyczne układu odpornościowego . Chociaż Leishmania występują na wszystkich kontynentach poza Antarktydą , Leishmania major występuje tylko na półkuli wschodniej , szczególnie w Afryce Północnej , na Bliskim Wschodzie , w północno-zachodnich Chinach i północno-zachodnich Indiach .
Biologia
Koło życia
Jako trypanosomatyda , L. major rozpoczyna swój cykl życiowy w postaci amastigota w jelicie środkowym głównego wektora , samicy muchy piaskowej ( Phlebotomus spp. ). Po wejściu do jelita muchy piaskowej pasożyty zmieniają się z amastigotów w wiciowce
biczowane promastigoty przez 1–2 tygodnie, aż do pełnego rozwoju, po czym docierają do trąby . Po ugryzieniu żywiciela- ssaka promastigoty są uwalniane do krwioobiegu , gdzie są pochłaniane przez makrofagi . Po pochłonięciu promastigoty różnicują się w amastigoty . Amastigoty są owalne lub okrągłe i mają średnicę między 2-3 μm . Dodatkowo zawierają duże, ekscentrycznie umieszczone jądro wraz z kinetoplastem (który zawiera zewnątrzkomórkowe DNA ). Będąc przygotowanymi do przetrwania w kwaśnym środowisku wewnątrz fagosomów makrofagów , amastigoty rozmnażają się w procesie rozszczepienia binarnego . W tym momencie amastigoty są uwalniane w całym ciele i mogą zostać połknięte przez samice much piaskowych , kończąc w ten sposób cykl. L. major ma cykl płciowy, w tym proces mejotyczny. Krycie występuje tylko w wektorze muchy piaskowej.
Zastępy niebieskie
Meriones unguiculatus , inne Meriones i jirds oraz inne gryzonie są częstymi żywicielami. Psy , Mustela nivalis , Atelerix algirus i Paraechinus aethiopicus są rzadkimi żywicielami. Bydło jest również często zarażone. Myszy są naturalnymi żywicielami. Transmisja między myszami odbywa się za pośrednictwem Phlebotomus papatasi .
Infekcja
Po wejściu do krwioobiegu ssaków L. major napotyka ognisko zakażenia , makrofagi . Dzięki dwóm cząsteczkom powierzchniowym , proteazie gp63 i lipofosfoglikanowi , promastigoty są w stanie wiązać się z kilkoma receptorami makrofagów . Przyłączanie promastigota do makrofagów jest ułatwione przez szereg receptorów , w tym receptory dopełniacza CR1 i CR3 oraz receptor końcowych produktów zaawansowanej glikozylacji . Aktywacja dopełniaczy zachodzi daleko od błony komórkowej , a insercja kompleksu atakującego błonę nie występuje. To działanie pozwala pasożytowi uniknąć lizy i przetrwać w makrofagach żywiciela . U bydła Th1 i Th2 są ważną częścią odpowiedzi. Żaden typ komórek nie wyraża wyłącznie IFNγ lub IL-4 dla L. dur – Brown et al. 1998 stwierdzili, że wyrażają oba u bydła. Bydlęcy mieloidalny peptyd przeciwdrobnoustrojowy BMAP-28 ma działanie leiszmanobójcze i może być użyteczny in vivo w zakażeniu bydła. Lynn i in. , 2011 uzyskali dobre wyniki przeciwko dwóm szczepom pasożyta, stosując dwie izoformy BMAP-28, retro-inverso i D-aminokwas.
enzymy
Dimetyloallilotransferaza jest niezbędna dla L. major , co czyni ją interesującym celem dla substancji o działaniu leiszmaniakalnym. Propenko i in. 2014 przedstawiają i zatwierdzają kilka inhibitorów transferazy dimetyloallilotransferazy.
Epidemiologia
Częstość występowania leiszmaniozy skórnej szacuje się na 1–1,5 miliona przypadków rocznie. Jednak transmisja często nie występuje w macicy , podczas transfuzji krwi lub poprzez kontakt międzyludzki. Tak więc główną formą przenoszenia jest wektor muchy piaskowej . Muchy piaskowe nie latają na duże odległości i zwykle kończą swój cykl życiowy na obszarach o średnicy mniejszej niż 1 km. Ponadto ze względu na skłonność much piaskowych aby szukać schronienia w norach małych gryzoni , gdzie L. major występuje endemicznie , głównym rezerwuarem są małe ssaki, takie jak myszoskoczki i ptaki . Udokumentowano również, że psy zarażały się skórną leiszmaniozą w Egipcie i Arabii Saudyjskiej . Jest to jednak rzadkie, a psy nie są ważnymi żywicielami L. major .
L. major i jego kuzyn L. tropica powodują większość przypadków skórnej leiszmaniozy na Bliskim Wschodzie , w Afryce Północnej oraz na niektórych obszarach Chin i Indii (jak wspomniano powyżej). W latach 2002-2004 zgłoszono ponad 700 przypadków tej choroby wśród Stanów Zjednoczonych służącego w Iraku .
Objawy kliniczne
Po zarażeniu pacjenci zwykle zgłaszają zmiany w miejscu ukąszenia muchy piaskowej . Infekcja jest ostra i zwykle trwa około 3–6 miesięcy. W miarę jak coraz więcej fagocytarnych pochłania promastigoty , pobudzając produkcję amastigotów , na skórze tworzą się guzki . Te guzki następnie owrzodzą , chociaż ze względu na zmienną charakterystykę zmian , specyficzna gatunkowo identyfikacja patogenu jest niemożliwa. Na ogół jednak zmiany wydają się wilgotne i mają uniesione zewnętrzne brzegi, ziarninującą podstawę, pokrywającą warstwę białego ropnego wysięku i zostały opisane jako „ podobne do pizzy ”. Biopsje tych zmian zwykle ujawniają szereg zmian, w tym liczne makrofagi zawierające wewnątrzkomórkowe amastigoty , a także limfocyty z obserwowanym ziarniniakiem formacja i kilka pasożytów .
Diagnoza
Leishmania major powinna być brana pod uwagę w diagnostyce różnicowej przewlekłych zmian chorobowych u osób, które przebywały na terenach endemicznych . Jednak inne patogeny mogą powodować podobne zmiany , a zatem parakokcydiodomykozę, histoplazmozę , sporotrychozę , lobomykozę , toczeń pospolity , Mycobacterium wrzodziejące , kiłę , sarkoidozę skórną i trąd wszystkie też powinny być brane pod uwagę.
Najczęstsze sposoby diagnozowania leiszmaniozy to identyfikacja amastigotów w preparacie dotykowym barwionym metodą Wrighta-Giemsy lub poprzez izolację pasożytów w hodowlach.
Leczenie
Ponieważ układ odpornościowy gospodarza ma tendencję do ustępowania infekcji po 3–6 miesiącach, leczenie zmian na ogół koncentruje się na ograniczeniu uszkodzeń i martwicy tkanek . Szereg różnych metod leczenia przyniosło wyniki o różnej skuteczności w leczeniu skórnej leiszmaniozy wywołanej przez L. major .
- Flukonazol podawany w dawkach 200 mg przez 6 tygodni spowodował wyleczenie w 90% w porównaniu z 60% w grupie otrzymującej placebo .
- Miejscowe stosowanie 15% paromomycyny i 12% metylobenzetonium było z powodzeniem stosowane w leczeniu pacjentów w Izraelu .
- iniekcje śródogniskowe 0,5–2,0 ml antymonu o stężeniu 100 mg/ml są skuteczne, gdy są wstrzykiwane wokół boków zmian chorobowych . Kiedy 10 takich zastrzyków podano pacjentom w Egipcie , 85% zostało wyleczonych w ciągu 3 miesięcy.
Zapobieganie
Rozprzestrzenianiu się leiszmaniozy można zapobiegać poprzez przerywanie cyklu życiowego muchy piaskowej lub usuwanie lub leczenie rezerwuarów patogenów . Unikanie much piaskowych jest skutecznym sposobem zapobiegania chorobom w przypadku osób odwiedzających krótkoterminowo obszary, na których L. major występuje endemicznie . Można to osiągnąć poprzez stosowanie DEET , stosowanie insektycydów na ubraniach i pościeli, a także stosowanie moskitier do przykrycia łóżek. Muchy piaskowe zwykle gryzą między zmierzchem a świtem , dlatego w tym czasie należy podjąć środki zapobiegawcze.
Chociaż nie istnieje jeszcze szczepionka , która mogłaby zapobiegać skórnej leiszmaniozie , spekuluje się, że zostanie ona opracowana w najbliższej przyszłości. Pacjenci, którzy wyzdrowieli z L. major, rozwijają odporność na patogen na wysokim poziomie . W Rosji i Izraelu żołnierze byli „immunizowani” przeciwko L. major poprzez wstrzyknięcie żywych promastigotów w pośladki ; jednak ta forma leczenia została przerwana w Izraelu ze względu na sporadyczne powstawanie dużych lub wolno gojących się zmian .
![]() Media związane z Leishmania major w Wikimedia Commons
Media związane z Leishmania major w Wikimedia Commons


