Neuroferrytynopatia
| Neuroferrytynopatia | |
|---|---|
| Inne nazwy | Choroba zwojów podstawy mózgu rozpoczynająca się w wieku dorosłym |
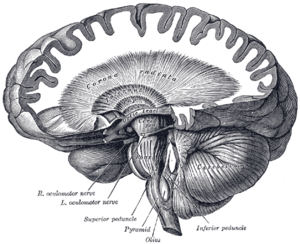 | |
| Móżdżek i zwoje podstawy | |
| Specjalność |
Neurologia |
Neuroferrytynopatia jest genetyczną chorobą neurodegeneracyjną charakteryzującą się gromadzeniem żelaza w zwojach podstawy , móżdżku i korze ruchowej ludzkiego mózgu. Objawy, które mają pozapiramidowy , postępują powoli i na ogół nie ujawniają się aż do wieku dorosłego. Objawy te obejmują pląsawicę , dystonię i deficyty poznawcze, które nasilają się wraz z wiekiem.
To zaburzenie jest autosomalne dominujące i jest spowodowane mutacjami w genie kodującym podjednostkę łańcucha lekkiego białka ferrytyny . Ferrytyna typu dzikiego działa jako bufor dla żelaza, sekwestrując je i kontrolując jego uwalnianie. Tak więc mutacje w łańcuchu lekkim ferrytyny powodują gromadzenie się żelaza w mózgu, co można zobrazować za pomocą MRI . Obecnie neuroferrytynopatia jest jedyną chorobą neurodegeneracyjną z nagromadzeniem żelaza w mózgu sklasyfikowaną jako zespół autosomalny dominujący.
Leczenie neuroferrytynopatii koncentruje się na leczeniu objawów związanych z pląsawicą i dystonią przy użyciu standardowych leków dla każdego z nich. Choroba postępuje, a objawy nasilają się wraz z wiekiem. Od czasu jej wykrycia w 2001 roku zgłoszono mniej niż 100 przypadków neuroferrytynopatii. Jej częstość występowania była w dużej mierze zlokalizowana w północno-wschodniej Anglii, co sugeruje efekt założyciela . Ze względu na swój genetyczny charakter obecne badania koncentrują się na leczeniu objawów spowodowanych przez zaburzenie.
Symptomy i objawy
Neuroferrytynopatia ma kilka charakterystycznych oznak i objawów. Dzielą się one na dwie kategorie: wyniki diagnostyczne i objawy widoczne fizycznie.
Wyniki diagnostyczne
Objawy sklasyfikowane jako przebadane i zdiagnozowane medycznie obejmują gromadzenie się żelaza w mózgu, kawitację zwojów podstawy mózgu i neurodegenerację . Pacjenci, u których zdiagnozowano neuroferrytynopatię , mają nieprawidłową akumulację żelaza w mózgu w neuronach i gleju prążkowia i kory móżdżku. Wraz z gromadzeniem się żelaza w mózgu neuroferrytynopatia zwykle powoduje również poważną utratę neuronów. Mogą również wystąpić objawy wtórne. Możliwe, że początkowa akumulacja żelaza spowoduje dodatkowe uszkodzenie neuronów i śmierć neuronów. Uszkodzone neurony mogą zostać zastąpione przez inne komórki w celu odwrócenia neurodegeneracji. Komórki te często mają wyższą zawartość żelaza. Rozpad bariery krew-mózg może również wystąpić z powodu utraty neuronów, co następnie pozwoli większej ilości żelaza na dostęp do mózgu i gromadzenie się w czasie.
Neuroferrytynopatia występuje głównie u osób, które osiągnęły późną dorosłość i ogólnie uważa się, że postępuje powoli przez wiele dziesięcioleci w ciągu życia, a średni wiek zachorowania wynosi 39 lat. Utratę funkcji poznawczych obserwuje się na ogół tylko w późnych stadiach choroby. Uważa się, że zdiagnozowani pacjenci zachowują większość swoich funkcji poznawczych do czasu wystąpienia najbardziej postępowych stadiów choroby.
Objawy fizyczne
Objawy sklasyfikowane jako objawy widoczne fizycznie obejmują pląsawicę , dystonię , spastyczność i sztywność , wszystkie fizyczne objawy ciała związane z zaburzeniami ruchowymi . Objawy towarzyszące neuroferrytynopatii wpływającej na ruch również mają charakter postępujący, z czasem ulegając uogólnieniu. Zwykle w ciągu pierwszych dziesięciu lat od początku choroby tylko jedna lub dwie kończyny są bezpośrednio zajęte. Charakterystycznymi objawami neuroferrytynopatii są pląsawica, występująca u 50% zdiagnozowanych pacjentów, dystonia, występująca u 43% pacjentów oraz parkinsonizm , stwierdzono u 7,5% pacjentów. Pełna kontrola kończyn górnych na ciele na ogół utrzymuje się do późnego początku choroby. Z biegiem czasu objawy obserwowane u pacjenta mogą zmieniać się z jednej strony ciała na przeciwną, przeskakując z lewej na prawą lub odwrotnie. Inną drogą, którą zaobserwowano fizycznie widoczne objawy, jest pojawienie się, zniknięcie, a następnie ponowne pojawienie się określonych objawów.
Chociaż objawy te są klasycznymi wskaźnikami neuroferrytynopatii, objawy będą się różnić w zależności od pacjenta.
Powoduje
Neuroferrytynopatia wynika z nieprawidłowej akumulacji żelaza w mózgu. Ta akumulacja żelaza jest spowodowana mutacjami w polipeptydzie FTL, który jest odpowiedzialny za kodowanie białek biorących udział w metabolizmie żelaza. Neuroferrytynopatia jest najczęściej spowodowana pojedynczą insercją nukleotydu adeniny do genu ferrytyny łańcucha L, co z kolei zmienia koniec karboksylowy całego łańcucha białkowego. Jednak dokładna lokalizacja insercji w eksonie zależy od rodziny. Neuroferrytynopatia może być również spowodowana wstawieniem dwóch dodatkowych zasad nukleotydowych. Wstawienie zasad do genu łańcucha L ferrytyny powoduje wydłużenie łańcucha i zmianę sekwencji aminokwasów znajdujących się w genie, znaną również jako mutacja przesunięcia ramki odczytu .
Mutacje te skutkują zmniejszoną zdolnością wiązania żelaza. Uszkodzenia oksydacyjne spowodowane przez zwiększone stężenie żelaza prowadzą do apoptozy lub zaprogramowanej śmierci komórki. Akumulacja żelaza w mózgu jest niezwykle niebezpieczna, ponieważ nadmiar żelaza katalizuje powstawanie wolnych rodników , które mają szkodliwy wpływ na mózg. Akumulacja żelaza charakterystyczna dla neuroferrytynopatii dotyczy szczególnie móżdżku, zwojów podstawy mózgu i kory ruchowej mózgu.
Mechanizm
Białko ferrytyna działa w celu sekwestracji i uwalniania żelaza, działając jako system buforowania żelaza w komórkach. Żelazo jest niezbędne do funkcjonowania mózgu, na przykład w transporcie tlenu i metabolizmie komórkowym. Jednak dokładna kontrola żelaza jest ważna, ponieważ podwyższony poziom żelaza w mózgu katalizuje powstawanie wolnych rodników , które tworzą cząsteczki utleniające poprzez reakcję Fentona . Te utleniające cząsteczki mogą powodować oksydacyjne uszkodzenie mózgu. Żelazo związane z ferrytyną w stanie niereaktywnym.
Reakcja Fentona
(1) Fe 2+ + H 2 O 2 → Fe 3+ + HO • + OH -
(2) Fe 3+ + H 2 O 2 → Fe 2+ + HOO• + H +
Białko ferrytyny składa się z podjednostek łańcucha ciężkiego (H) i lekkiego (L) . W neuroferrytynopatii gen kodujący łańcuch lekki jest zmutowany. Kilka różnych odmian mutacji doprowadziło do diagnozy jako neuroferrytynopatia; wszystkie te mutacje występują w łańcuchu lekkim. Uważa się, że zmutowany łańcuch lekki hamuje zdolność ferrytyny do skutecznego sekwestrowania i zatrzymywania żelaza. Bez kontroli nad żelazem może ono powodować oksydacyjne uszkodzenie mózgu, jak opisano powyżej.
Stężenie żelaza w zdrowym mózgu różni się znacznie w zależności od regionu. Specyficzne obszary mózgu, które są związane z funkcjami motorycznymi, wydają się mieć większe nagromadzenie żelaza niż obszary niezwiązane z motoryką. Ta obserwacja różnych stężeń żelaza jest możliwym wyjaśnieniem korelacji między zaburzeniami ruchu a brakiem równowagi żelaza w ośrodkowym układzie nerwowym.
Diagnoza
Neuroferrytynopatię diagnozuje się przede wszystkim u osób starszych, szczególnie u osób dorosłych dotkniętych chorobą Alzheimera lub chorobą Parkinsona , ponieważ żelazo gromadzi się w mózgu przez długi czas. Neuroferrytynopatię diagnozuje się za pomocą technik neuroobrazowania, testów fizjologicznych lub testów genetycznych.
Klasyfikacja
Neuroferrytynopatia została pierwotnie opisana z charakterystycznymi cechami neurodegeneracji i akumulacji żelaza w mózgu, co doprowadziło do zaklasyfikowania jej do innych zaburzeń neurodegeneracji z akumulacją żelaza w mózgu (NBIA), które mają podobne objawy i wyniki badań obrazowych. Z biegiem czasu znaleziono przyczyny wielu zaburzeń NBIA, takich jak neuroferrytynopatia. Przed udostępnieniem testów genetycznych wszystkie takie zaburzenia były rozpatrywane łącznie i znane jako zespół Hallervordena-Spatza, termin, który nie jest już używany ze względu na partię nazistowską więzi imienników. Zaburzenia związane z żelazem w mózgu są obecnie podzielone na trzy kategorie: genetyczna neurodegeneracja z akumulacją żelaza w mózgu , genetyczna ogólnoustrojowa akumulacja żelaza z cechami neurologicznymi oraz choroby nabyte związane z nadmiarem lub niedoborem żelaza. Neuroferrytynopatia jest klasyfikowana w pierwszej kategorii. Neuroferrytynopatia jest klasyfikowana jako zwojów podstawy mózgu o późnym początku i jest chorobą neurodegeneracyjną dziedziczoną w sposób dominujący. Cztery różne allele są odpowiedzialne za neuroferrytynopatię. Trzy powstają z nukleotydów w łańcucha lekkiego ferrytyny (FTL), podczas gdy czwarty powstaje w wyniku mutacji zmiany sensu w genie FTL.
Neuroobrazowanie
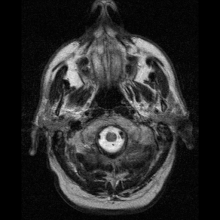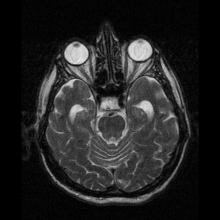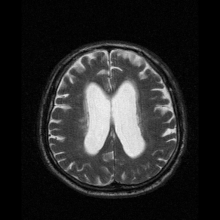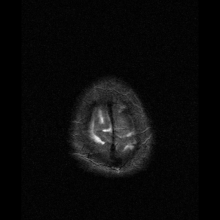
Neuroferrytynopatię najczęściej diagnozuje się za pomocą MRI i innych technik neuroobrazowania. MRI pomagają zidentyfikować złogi żelaza w móżdżku, zwojach podstawy mózgu i korze ruchowej, które są wspólne dla neuroferrytynopatii. MRI osób dotkniętych chorobą wykazuje również łagodną atrofię móżdżku i mózgu lub rozpad tkanki i tworzenie się jamy gazowej w skorupie . Co najważniejsze, MRI pokazuje nieprawidłowo sfałdowane białka ferrytyny i złogi żelaza w komórkach glejowych jądra ogoniastego, skorupie, gałce bladej, korze mózgowej, wzgórzu i komórkach Purkinjego , powodując śmierć neuronów w tych obszarach.
Testy fizjologiczne
Badania krwi zwykle wracają do normy u osób dotkniętych chorobą, więc nie służą jako niezawodny sposób diagnozy. Badania krwi mogą wykazać niski w surowicy . Jest to jednak niewiarygodna metoda diagnostyczna, ponieważ niektórzy pacjenci wykazują typowe poziomy ferrytyny w surowicy nawet w ostatnich stadiach neuroferrytynopatii. Testy płynu mózgowo-rdzeniowego również są zwykle normalne. Agregaty ferrytyny znajdujące się w skórze, wątrobie, nerkach i tkankach mięśniowych mogą pomóc w rozpoznaniu neuroferrytynopatii. W biopsjach mięśni często stwierdza się również więcej włókien ujemnych pod względem oksydazy cytochromu c dotkniętych osób.
Badania genetyczne
Testy genetyczne mogą potwierdzić diagnozę neuroferrytynopatii. Diagnozę można postawić, analizując sekwencje białkowe osób dotkniętych chorobą i porównując je ze znanymi sekwencjami neuroferrytynopatii.
Leczenie
Ze względu na genetyczną etiologię neuroferrytynopatii zaburzenie to nie jest obecnie uleczalne. Ponadto postęp choroby nie może być skutecznie zatrzymany. Dlatego obecne leczenie koncentruje się na leczeniu objawów zaburzenia. Żaden lek nie jest dostępny do leczenia wszystkich objawów. Wykazano, że botoks pomaga w dystonii ogniskowej. Wykazano, że tetrabenazyna zubożająca dopaminę pomaga w ruchach mimowolnych. Objawy wpływające na ruch (dystonia) leczono również L-Dopą , orfenadryną , benzheksolem , sulpirydem , diazepam , klonazepam i deanol . L-Dopa nie zmniejszała objawów choroby Parkinsona . Należy unikać suplementów żelaza.
Epidemiologia
Neuroferrytynopatię po raz pierwszy odkryto w 2001 roku, a jej pierwszy przypadek odnotowano w Cumbrii w północnej Anglii. W odkryciu neuroferrytynopatii pośredniczyło badanie przeprowadzone na dużej rodzinie cierpiącej na dziedziczną w sposób dominujący chorobę zwojów podstawy mózgu. Zgłoszono, że choroba jest wywoływana przez mutację polipeptydu łańcucha lekkiego ferrytyny (FTL1) i stwierdzono, że powoduje gromadzenie się żelaza w mózgu i neurodegenerację. Podobnie jak w przypadku lokalizacji pierwszego przypadku neuroferrytynopatii, większość pacjentów, u których zdiagnozowano tę chorobę, stwierdzono również w północnej i północno-wschodniej Anglii. Lokalizacja większości przypadków w północnej i północno-wschodniej Anglii sugeruje, że wspólny przodek może być odpowiedzialny za wiele lub prawdopodobnie wszystkie przypadki. Pomimo zgłoszonych mniej niż 100 przypadków i ogólnej lokalizacji choroby w północnej i północno-wschodniej Anglii, w ostatnich latach zdiagnozowano o wiele więcej przypadków neuroferrytynopatii na całym świecie.
Badania
Badane nowe potencjalne opcje leczenia to wenezja (usuwanie czerwonych krwinek), chelatowanie żelaza za pomocą deferypronu i koenzym Q10 (ubichinon) .