Pinitol
|
|
| Nazwy | |
|---|---|
|
Preferowana nazwa IUPAC
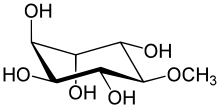
(1R , 2S , 3R , 4S , 5S , 6S ) -6-metoksycykloheksano-1,2,3,4,5-pentol |
|
| Inne nazwy 3- O -Metylo- D - chiro -inozytol D -(+)- chiro -inozytol D -Pinitol Inzitol D -(+)-Pinitol (+)-Pinitol Sennitol Pinnitol |
|
| Identyfikatory | |
|
Model 3D ( JSmol )
|
|
| ChEBI | |
| ChEMBL | |
| ChemSpider | |
|
PubChem CID
|
|
| UNII | |
|
Panel kontrolny CompTox ( EPA )
|
|
|
|
|
|
| Nieruchomości | |
| C 7 H 14 O 6 | |
| Masa cząsteczkowa | 194,183 g·mol -1 |
| Temperatura topnienia | 179 do 185 ° C (354 do 365 ° F; 452 do 458 K) |
|
O ile nie zaznaczono inaczej, dane podano dla materiałów w ich stanie standardowym (w temperaturze 25 °C [77 °F], 100 kPa).
|
|
Pinitol jest cyklitolem , cyklicznym poliolem . Jest znanym przeciwcukrzycowym izolowanym z liści Sutherlandia frutescens . Garbniki roślinne żółciowe można rozróżnić na podstawie zawartości pinitolu. Po raz pierwszy zidentyfikowano go u sosny cukrowej ( Pinus lambertiana ). Występuje także w innych roślinach, na przykład w strąkach drzewa świętojańskiego .
Pewne warianty bakterii Pseudomonas putida zostały wykorzystane w syntezie organicznej , pierwszym przykładem jest utlenianie benzenu , zastosowane przez Stevena Leya w syntezie (±)-pinitolu.
Glikozydy
Ciceritol to digalaktozyd pinitolu , który można wyizolować z nasion ciecierzycy , soczewicy i łubinu białego .
Pochodną cyklitolu można znaleźć w gąbce morskiej Petrosia sp.
Biosynteza
D-pinitol jest najszerzej rozpowszechnionym eterem inozytolu w roślinach. U roślin okrytonasiennych D-pinitol charakteryzuje się stosunkowo prostą i krótką biosyntezą, która przebiega szlakiem Loewusa. Prekursorem szlaku biosyntezy jest glukozo-6-fosforan, który poprzez mio-inozytol przekształca się w D-ononitol (1-D-4-O-metylo-mio-inozytol). Ononitol ulega epimeryzacji z wytworzeniem D-pinitolu za pośrednictwem epimerazy D-ononitolu przy użyciu NADPH jako kofaktora.