Rubicordifolina

|
|
| Nazwy | |
|---|---|
|
Preferowana nazwa IUPAC
5-hydroksy-2-[(2R , 3aR , 4R ) -7-hydroksy-4-(2-hydroksypropan-2-ylo)-2-metylo-6-okso-2,3,3a,6 metylu -tetrahydro-4H - benzo[ h ]pirano[3,4,5- de ][1]benzopiran-2-ylo]nafto[1,2- b ]furano-4-karboksylan |
|
| Identyfikatory | |
|
Model 3D ( JSmol )
|
|
| ChemSpider | |
|
Identyfikator klienta PubChem
|
|
| UNII | |
|
|
|
|
| Nieruchomości | |
| C33H28O9 _ _ _ _ _ | |
| Masa cząsteczkowa | 568,578 g · mol -1 |
|
O ile nie zaznaczono inaczej, dane podano dla materiałów w stanie normalnym (przy 25°C [77°F], 100 kPa).
|
|
Rubicordifolina jest produktem naturalnym wytwarzanym przez Rubia cordifolia , roślinę z rodziny Rubiaceae . Cząsteczka została wyizolowana z korzeni Rubia cordifolia i została po raz pierwszy scharakteryzowana w 1993 roku. W 2004 roku dokonano pierwszej syntezy rubicordifoliny. Wykazano, że cząsteczka ma właściwości cytotoksyczne in vitro .
Biosynteza
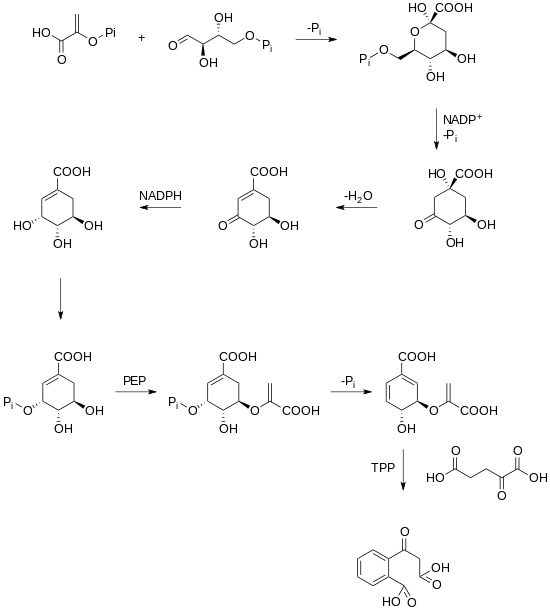
Szlak biosyntezy rubicordifoliny nie został jeszcze wyjaśniony. Postawiono jednak hipotezę, że dimeryzacja dwóch jednostek naftochinonu daje rubicordifolinę. Naftochinony można prześledzić wstecz do szlaku szikimowego w roślinach. Szikimat jest przekształcany w kwas choryzmowy , który jest następnie przekształcany w kwas 2-sukcynylobenzoesowy w reakcji zależnej od TPP.
Po wytworzeniu kwasu 2-sukcynylobenzoesowego następuje cyklizacja, prenylacja, metylacja i utlenianie, w wyniku czego powstaje naftochinon.
Po wytworzeniu tego naftochinonu seria utleniań i cyklizacji prowadzi do dwóch substratów, które mogą ulec cykloaddycji [4 + 2] prowadzącej do produktu.
Synteza
Grupa Trauner z UC Berkeley zakończyła syntezę rubicordifoliny w 2004 roku. Synteza produktu naturalnego, nazwanego syntezą „biomimetyczną”, czerpie inspirację z proponowanej dimeryzacji dwóch jednostek naftochinonu. Mechanistycznie proponuje się, aby kwas fenyloborowy sprzyjał cyklizacji, po której następuje reakcja Dielsa-Aldera , dająca produkt końcowy.
Farmakologia
Badania rubicordifoliny wykazują, że posiada ona zarówno właściwości cytotoksyczne. Podczas testowania in vitro przeciwko fibroblastom płuc chomika chińskiego , ludzkim rakom nosogardzieli i komórkom białaczki limfatycznej rubicordifolina wykazywała aktywność cytotoksyczną (mierzoną jako IC50 , μg/ml) odpowiednio 4,7, 2,9 i 1,2.