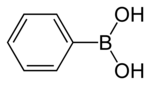
Kwas fenyloborowy
|
|
|
|
| Nazwy | |
|---|---|
|
Preferowana nazwa IUPAC
Kwas fenyloborowy |
|
| Identyfikatory | |
|
Model 3D ( JSmol )
|
|
| 970972 | |
| CHEBI | |
| CHEMBL | |
| ChemSpider | |
| Bank Leków | |
| Karta informacyjna ECHA | 100.002.456 |
| Numer WE |
|
| 3328 | |
|
Identyfikator klienta PubChem
|
|
| UNII | |
|
Pulpit nawigacyjny CompTox ( EPA )
|
|
|
|
|
|
| Nieruchomości | |
| C 6 H 7 BO 2 | |
| Masa cząsteczkowa | 121,93 g/mol |
| Wygląd | biały do żółtego proszek |
| Zapach | bezwonny |
| Temperatura topnienia | 216 ° C (421 ° F; 489 K) |
| 10 g/l (20ºC) | |
| Rozpuszczalność | rozpuszczalny w eterze dietylowym , etanolu |
| Kwasowość ( p Ka ) | 8.83 |
| Termochemia | |
|
Standardowa entalpia formowania (Δ f H ⦵ 298 ) |
-719,6 kJ/mol |
| Zagrożenia | |
| Oznakowanie GHS : | |

|
|
| Ostrzeżenie | |
| H302 | |
| P261 , P264 , P270 , P271 , P280 , P301+P312 , P302+P352 , P304+P340 , P305+P351+P338 , P312 , P321 , P330 , P332 +P313 , P337+P313 , P36 2 , P403 + P233 , P405 , P501 | |
| Śmiertelna dawka lub stężenie (LD, LC): | |
|
LD 50 ( mediana dawki )
|
740 mg/ml (szczur, doustnie) |
| Karta charakterystyki (SDS) | [1] |
|
O ile nie zaznaczono inaczej, dane podano dla materiałów w stanie normalnym (przy 25°C [77°F], 100 kPa).
|
|
Kwas fenyloborowy lub kwas benzenoborowy , w skrócie PhB(OH) , 2 gdzie Ph oznacza grupę fenylową C6H5- , jest kwasem boronowym zawierającym podstawnik fenylowy i dwie grupy hydroksylowe przyłączone do boru . Kwas fenyloborowy jest białym proszkiem i jest powszechnie stosowany w syntezie organicznej . Kwasy boronowe to łagodne kwasy Lewisa które są na ogół stabilne i łatwe w obsłudze, co czyni je ważnymi dla syntezy organicznej.
Nieruchomości
Kwas fenyloborowy jest rozpuszczalny w większości polarnych rozpuszczalników organicznych i jest słabo rozpuszczalny w heksanach i tetrachlorku węgla . Ten planarny związek ma wyidealizowaną symetrię cząsteczkową C2V . Atom boru jest hybrydyzowany sp 2 i zawiera pusty orbital p . Kryształy rombowe wykorzystują wiązania wodorowe do tworzenia jednostek składających się z dwóch cząsteczek. Te jednostki dimeryczne są łączone, tworząc rozszerzoną sieć wiązań wodorowych . Cząsteczka jest płaska z niewielkim zagięciem wokół wiązania CB wynoszącym 6,6° i 21,4° dla dwóch cząsteczek PhB(OH) 2 .
Synteza
Istnieje wiele metod syntezy kwasu fenyloborowego. Jedna z najczęstszych syntez wykorzystuje bromek fenylomagnezu i boran trimetylu do utworzenia estru PhB(OMe) 2 , który jest następnie hydrolizowany do produktu.
- PhMgBr + B(OMe) 3 → PhB(OMe) 2 + MeOMgBr
- PhB(OMe) 2 + H2O → PhB(OH) 2 + MeOH
Inne drogi do kwasu fenyloborowego obejmują elektrofilowe borany do wychwytywania związków pośrednich fenylometali z halogenków fenylu lub z ukierunkowanej ortometalacji . Transmetalany fenylosilanów i fenylostannanów z BBr 3 , a następnie hydroliza do kwasu fenyloborowego. Halogenki lub triflaty arylu można sprzęgać z odczynnikami diboronylowymi przy użyciu katalizatorów z metali przejściowych. Aromatyczną funkcjonalizację CH można również przeprowadzić przy użyciu katalizatorów z metali przejściowych .
Reakcje
Odwodnienie kwasów boronowych daje boroksyny , trimeryczne bezwodniki kwasu fenyloborowego. Reakcja odwodnienia jest prowadzona termicznie, czasami za pomocą środka odwadniającego .
Kwas fenyloborowy uczestniczy w wielu reakcjach sprzęgania krzyżowego , w których służy jako źródło grupy fenylowej. Jednym z przykładów jest reakcja Suzuki , w której w obecności katalizatora i zasady Pd(0) kwas fenyloborowy i halogenki winylu są sprzęgane w celu wytworzenia fenyloalkenów . Metodę tę uogólniono na drogę wytwarzania biaryli przez sprzęganie kwasu fenyloboronowego z halogenkami arylowymi.
Procesy tworzenia wiązań CC zwykle wykorzystują kwas fenyloborowy jako odczynnik. Alfa-aminokwasy można wytwarzać za pomocą niekatalizowanej reakcji między alfa-ketokwasami , aminami i kwasem fenyloborowym. Wykazano sprzężenie krzyżowe typu Hecka kwasu fenyloborowego z alkenami i alkinami.
Azydki arylu i związki nitroaromatyczne można również wytwarzać z kwasu fenyloborowego. Kwas fenyloborowy można również regioselektywnie fluorowcoborować przy użyciu wodnego roztworu bromu , chloru lub jodu :
- PhB(OH) 2 + Br 2 + H 2 O → PhBr + B(OH) 3 + HBr
Estry boronowe powstają w wyniku kondensacji kwasów boronowych z alkoholami . Ta przemiana polega po prostu na zastąpieniu grupy hydroksylowej alkoksylowymi lub aryloksylowymi . Ta odwracalna reakcja jest zwykle doprowadzana do produktu za pomocą aparatu Deana-Starka lub środka odwadniającego w celu usunięcia wody.
- PhB(OH) 2 + 2 ROH ⇌ PhB(OR) 2 + 2 H 2 O
Jako rozszerzenie tej reaktywności, PhB(OH) 2 może być stosowany jako grupa zabezpieczająca dla dioli i diamin . Ta reaktywność jest podstawą zastosowania kwasu fenyloborowego jako receptora i czujnika węglowodanów, przeciwdrobnoustrojowych i inhibitorów enzymów , terapii wychwytu neutronów w leczeniu raka , transportu przezbłonowego oraz biokoniugacji i znakowania białek i powierzchni komórek.
Zobacz też
Dalsza lektura
- Brown, HC Organie Synthesis via Boranses , Wiley, Nowy Jork, 1975.
- Matteson, DS Stereodirected Synthesis with Organoboranes , Springer, Berlin, 1995 . ISBN 978-3-540-59182-5
- Lapperta, MF (1956). „Organiczne związki boru”. chemia Obj. 56 (5): 959–1064. doi : 10.1021/cr50011a002 .
- Peltera, A.; Smith, K.; Brown, HC Borane Reagents , Academic Press, Nowy Jork, 1988.
- Michajłow, BM; Bubnov, YN Związki boroorganiczne w syntezie organicznej , Harwood Academics, Glasgow, 1984. ISBN 3-7186-0113-3
