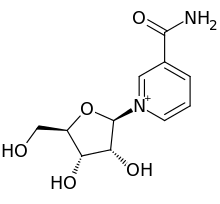
Rybozyd nikotynamidu
|
|

|
|
| Nazwy | |
|---|---|
|
Preferowana nazwa IUPAC
3-karbamoilo-1-[(2R , 3R , 4S , 5R ) -3,4-dihydroksy-5-(hydroksymetylo)oksolan-2-ylo]pirydyn-1-ium |
|
| Inne nazwy 1-(β- D -Rybofuranozylo)nikotynamid; N -Rybozylnikotynamid
|
|
| Identyfikatory | |
|
Model 3D ( JSmol )
|
|
| CHEBI | |
| ChemSpider | |
|
Identyfikator klienta PubChem
|
|
| UNII | |
|
Pulpit nawigacyjny CompTox ( EPA )
|
|
|
|
|
|
| Nieruchomości | |
| C11H15N2O5 + _ _ _ _ _ _ _ | |
| Masa cząsteczkowa | 255,25 g/mol |
|
O ile nie zaznaczono inaczej, dane podano dla materiałów w stanie normalnym (przy 25°C [77°F], 100 kPa).
|
|
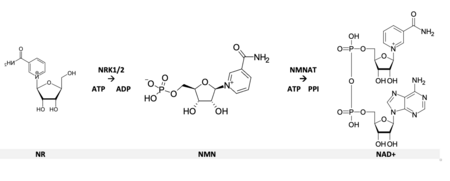
Rybozyd nikotynamidu ( NR , SR647 ) jest pirydyno - nukleozydem i formą witaminy B3 . Działa jako prekursor dinukleotydu nikotynoamidoadeninowego lub NAD + poprzez dwuetapowy i trzyetapowy szlak.
Chemia
Masa cząsteczkowa rybozydu nikotynamidu wynosi 255,25 g/mol, a jego chlorku 290,70 g/mol. Jako takie, 100 mg chlorku rybozydu nikotynamidu dostarcza 88 mg rybozydu nikotynamidu.
Historia
Rybozyd nikotynamidu (NR) został zidentyfikowany jako prekursor NAD, zaangażowany w ratunkową syntezę NAD zarówno u bakterii , jak i eukariotów . W bakteriach został po raz pierwszy opisany w 1944 r. jako niezbędny czynnik wzrostu w hodowli Haemophilus influenza . H. influenza została zidentyfikowana jako wymagająca do wzrostu zarówno czynnika X ( heminy ), jak i czynnika V (NAD). Wykazano, że czynnik V oczyszczony z krwi występuje w trzech postaciach: dinukleotyd nikotynoamidoadeninowy (NAD+), NMN i NR. NR był związkiem, który doprowadził do najszybszego wzrostu bakterii H. influenza .
H. influenza nie może rosnąć na kwasie nikotynowym (NA), nikotynamidzie (NAM) ani aminokwasach, takich jak tryptofan (Trp) lub kwas asparaginowy (Asp), które były wcześniej znanymi prekursorami NAD+. H. influenza zależy całkowicie od odzyskiwania prekursorów NAD z innych komórek w swoim środowisku.
Identyfikacja rybozydu nikotynamidu (NR) jako prekursora NAD u eukariotów rozwinęła się na podstawie badań nad pelagrą . Pellagra była pierwszą chorobą związaną z niedoborem NAD+. Została powiązana z niedoborami żywieniowymi przez Josepha Goldbergera w 1914 roku, a z niedoborem niacyny ( witaminy B 3 ) przez Conrada Elvehjem w 1937 r. Wykazano, że NAD + (wtedy nazywany koenzymem I) był wyjątkowo niski w przypadkach pelagry, a NA i NAM zidentyfikowano jako molekularne prekursory w odbudowie poziomów NAD +. Pelagra jest obecnie rozumiana jako ciężkie, chroniczne wyczerpanie NAD+, które można leczyć dietą.
Późniejsze badania metabolizmu NAD+ pozwoliły zidentyfikować szlaki regulacyjne wykorzystywane przez komórki i tkanki do utrzymania dostępności NAD+. Wykazano, że NAD+ i jego prekursory, kwas nikotynowy (NA) i nikotynamid (NAM), są istotnymi kofaktorami w komórkowych reakcjach utleniania/redukcji i syntezie ATP . Klasyczne szlaki syntezy NAD+ scharakteryzowane u eukariontów obejmują ośmioetapowy szlak de novo z Trp i dwa szlaki wykorzystujące prekursory NAD+ NA i NAM: trzyetapowy szlak oparty na NA, znany jako szlak Preissa-Handlera; oraz szlak oparty na NAM z udziałem enzymu Fosforybozylotransferaza nikotynamidu (NAMPT) i tworzenie mononukleotydu nikotynamidu (NMN).
W 2004 roku opisano nieznany wcześniej szlak, gdy rybozyd nikotynamidu (NR) został zidentyfikowany jako dodatkowy prekursor NAD+ u eukariontów . NR jest obecnie rozpoznawany jako forma witaminy B 3 , którą można znaleźć zarówno w mleku krowim, jak i ludzkim. Po internalizacji do komórki NR jest szybko fosforylowany przez aktywność enzymów kinazy rybozydowej nikotynamidu (NRK1 i NRK2), tworząc mononukleotyd nikotynamidu (NMN), z pominięciem znanych wcześniej szlaków biosyntezy do produkcji NAD+. NMN jest następnie przekształcany w NAD+ przez NMN-adenylilotransferazę (NMNAT).
Badania na ssakach wskazują, że NRK1 jest białkiem cytozolowym, kodowanym przez gen Nmrk1 . Występuje w większości tkanek, ale głównie w wątrobie i nerkach. Białko NRK2 może być związane z tkanką mięśniową, w tym z mięśniem sercowym. Jest kodowany przez Nmrk2 i wydaje się, że ulega większej ekspresji w przypadkach stresu metabolicznego lub uszkodzenia komórek. Ponieważ różne typy tkanek wykazują różne stężenia NR i NRK, prawdopodobne jest, że wykorzystanie NR będzie się różnić w różnych tkankach.
Badania metaboliczne wskazują, że NAD+, kiedyś uważany za stabilną cząsteczkę, jest stale odnawiany i używany, co wymaga ścisłej regulacji w celu utrzymania homeostazy metabolicznej. Wykorzystanie NR u ssaków może obejmować zarówno egzogenne źródła pokarmowe, jak i endogenne procesy odzyskiwania, które przetwarzają półprodukty. Metabolizm NR i interakcje różnych szlaków NAD+ są nadal przedmiotem badań. Szlaki NAM i NR obejmują grupę amidową i są określane jako szlaki „amidowane”. Ścieżki de novo synteza z tryptofanu i z odzysku NA to szlaki „dezamidowane”, które mają wspólny ograniczający szybkość enzym amidujący NADsynthase1 (NADSYN). Zakłócenia lub brak równowagi w metabolizmie NAD+ obserwowano w wielu stanach chorobowych, a możliwość przywrócenia poziomu NAD+ poprzez podawanie prekursorów NAD+ jest obszarem zainteresowania badaczy.
Biosynteza
Obecnie wiadomo, że rybozyd nikotynamidu (NR) jest prekursorem NAD+, zaangażowanym w szlaki biosyntezy, które przekształcają witaminy B3 w NAD+. NAD+ jest głównie syntetyzowany u ssaków de novo z tryptofanu, szlakiem Priess-Handler z kwasu nikotynowego (NA) lub szlakiem ratunkowym z nikotynamidu (NAM).
Rybozyd nikotynamidu (NR) jest wykorzystywany przez dodatkowy szlak obejmujący fosforylację przez enzymy kinazy rybozydowej nikotynamidu (NRK1 i NRK2). U drożdży wykazano również, że NR jest rozkładany przez nukleozydazy Pnp1, Urh1 i Meu1, zanim zostanie przekształcony w NAD⁺ poprzez szlak Preissa-Handlera i działanie amidazy nikotynowej Pnc1.
Komercjalizacja
Firma ChromaDex uzyskała licencję na patenty w lipcu 2012 r. i zaczęła opracowywać proces wprowadzania NR na rynek jako TruNiagen. ChromaDex toczy spór patentowy z Elysium Health dotyczący praw do suplementów rybozydu nikotynamidu od 2016 roku.
Oznaczenia bezpieczeństwa
W 2016 roku amerykańska Agencja ds. Żywności i Leków (FDA) przyznała produktowi ChromaDex status ogólnie uznanego za bezpieczny (GRAS) za preparat chlorku rybozydu nikotynamidu (NRC, Niagen™). Został wyznaczony jako nowy składnik diety (NDI) do stosowania w suplementach diety przez Amerykańską Agencję ds. Żywności i Leków w 2015 i 2017 r. W 2018 r. Został wymieniony w bazie danych licencjonowanych naturalnych produktów zdrowotnych (LNHPD) Health Canada. Unia Europejska przyznała NRC oznaczenie „Nowy składnik dietetyczny” jako nowa żywność zgodnie z rozporządzeniem (UE) 2015/2283 od 2019 r. Został dopuszczony do stosowania w suplementach diety przez UE w 2020 r. Panel EFSA ds. żywienia, nowej żywności i alergenów pokarmowych (NDA) uznała, że od 2021 r. jest równie bezpieczny jak czysty nikotynamid do stosowania w żywności specjalnego przeznaczenia medycznego (FSMP) i środkach spożywczych zastępujących całodzienną dietę, do kontroli masy ciała (TDRWC), ale zauważyła, że konieczne będą dalsze badania w celu ustalenia bezpieczeństwa dla niektórych innych rodzaje użytkowania. Rząd Australii umieścił chlorek rybozydu nikotynamidu na pozytywnej liście zgodnie z wytycznymi dotyczącymi składu jego Therapeutic Goods Administration (TGA).
Zobacz też
- Mononukleotyd nikotynamidu
- Niacyna
- nikotynamid
- Witamina B3
- Dinukleotyd nikotynamidoadeninowy
- Sirtuina
- Polimeraza poli (ADP-rybozy).