Związki azotu
Pierwiastek chemiczny azot jest jednym z najbardziej rozpowszechnionych pierwiastków we wszechświecie i może tworzyć wiele związków. Może przyjmować kilka stopni utlenienia ; ale większość stopni utlenienia to -3 i +3. Azot może tworzyć jony azotkowe i azotanowe . Wchodzi także w skład kwasu azotowego i soli azotanowych. Związki azotu odgrywają również ważną rolę w chemii organicznej, ponieważ azot jest częścią białek , aminokwasów i trójfosforanu adenozyny .
Kompleksy diazotowe

Pierwszym odkrytym przykładem kompleksu diazotowego był [Ru(NH 3 ) 5 (N 2 )] 2+ (patrz rysunek po prawej), a wkrótce odkryto wiele innych takich kompleksów. Te kompleksy , w których cząsteczka azotu przekazuje co najmniej jedną wolną parę elektronów centralnemu kationowi metalu, ilustrują, w jaki sposób N2 może wiązać się z metalem(ami) w azotazie i katalizatorze procesu Habera : te procesy związane z aktywacją diazotu są niezwykle ważne w biologii i produkcji nawozów.
Diazot jest w stanie koordynować metale na pięć różnych sposobów. Bardziej dobrze scharakteryzowane są drogi końcowe M←N≡N ( η 1 ) i M←N≡N→M ( μ , bis- η 1 ), w których wolne pary na atomach azotu są przekazywane do kation metalu. Mniej scharakteryzowane sposoby obejmują dostarczanie par elektronów z wiązania potrójnego przez diazot, albo jako ligand mostkujący do dwóch kationów metali ( μ , bis- η 2 ) lub tylko do jednego ( η 2 ). Piąta i unikalna metoda obejmuje potrójną koordynację jako ligand mostkujący, przekazujący wszystkie trzy pary elektronów z potrójnego wiązania ( μ 3 -N 2 ). Kilka kompleksów zawiera wiele ligandów N2, a niektóre zawierają N2 związany na wiele sposobów. Ponieważ N 2 jest izoelektroniczny z tlenkiem węgla (CO) i acetylenem (C 2 H 2 ), wiązanie w kompleksach diazotu jest blisko spokrewnione z wiązaniem w związkach karbonylowych , chociaż N 2 jest słabszym donorem σ i akceptorem π niż CO. Badania teoretyczne pokazują, że donacja σ jest ważniejszym czynnikiem umożliwiającym tworzenie wiązania M – N niż donacja wsteczna π , która w większości osłabia jedynie wiązanie N – N, oraz darowizna końcowa ( η 1 ) jest łatwiejsza do zrealizowania niż darowizna boczna ( η 2 ).
Obecnie kompleksy diazotu są znane z prawie wszystkich metali przejściowych , co stanowi kilkaset związków. Zwykle są przygotowywane trzema metodami:
- Zastąpienie nietrwałych ligandów, takich jak H 2 O , H − lub CO bezpośrednio przez azot: są to często reakcje odwracalne, które zachodzą w łagodnych warunkach.
- Redukcja kompleksów metali w obecności odpowiedniego koligandu w nadmiarze w atmosferze gazowego azotu. Powszechny wybór obejmuje zastąpienie ligandów chlorkowych dimetylofenylofosfiną (PMe 2 Ph) w celu uzupełnienia mniejszej liczby przyłączonych ligandów azotowych niż oryginalne ligandy chlorowe.
- Przekształcenie ligandu z wiązaniami N – N, takiego jak hydrazyna lub azydek, bezpośrednio w ligand diazotowy.
Czasami wiązanie N≡N może powstać bezpośrednio w kompleksie metalu, na przykład poprzez bezpośrednią reakcję skoordynowanego amoniaku (NH 3 ) z kwasem azotawym (HNO 2 ), ale nie ma to ogólnego zastosowania. Większość kompleksów diazotu ma kolory z zakresu biało-żółto-pomarańczowego-czerwono-brązowego; jest kilka wyjątków, takich jak niebieski [{Ti( η5 - C5H5 ) 2 } 2- ( N2 ) ] .
Azotki, azydki i kompleksy azotowe
Azot wiąże się z prawie wszystkimi pierwiastkami w układzie okresowym, z wyjątkiem pierwszych trzech gazów szlachetnych , helu , neonu i argonu , oraz niektórych bardzo krótko żyjących pierwiastków po bizmucie , tworząc ogromną różnorodność związków podwójnych o różnych właściwościach i zastosowaniach. Znanych jest wiele związków dwuskładnikowych: z wyjątkiem wodorków, tlenków i fluorków azotu, są one zwykle nazywane azotkami . Dla większości pierwiastków zwykle występuje wiele faz stechiometrycznych (np. MnN, Mn 6 N 5 , Mn 3N2 , Mn2N , Mn4N i MnxN dla 9,2 < x < 25,3 ) . Można je sklasyfikować jako „podobne do soli” (głównie jonowe), kowalencyjne, „podobne do diamentu” i metaliczne (lub śródmiąższowe ) , chociaż ta klasyfikacja ma ograniczenia wynikające generalnie z ciągłości typów wiązań zamiast dyskretnych i oddzielnych typów że to implikuje. Zwykle wytwarza się je poprzez bezpośrednią reakcję metalu z azotem lub amoniakiem (czasami po podgrzaniu) lub przez termiczny rozkład amidków metali:
- 3 Ca + N 2 → Ca 3 N 2
- 3 Mg + 2 NH 3 → Mg 3 N 2 + 3 H 2 (przy 900 °C)
- 3 Zn(NH 2 ) 2 → Zn 3 N 2 + 4 NH 3
Możliwych jest wiele wariantów tych procesów. Najbardziej jonowe z tych azotków to azotki metali alkalicznych i metali ziem alkalicznych , Li 3 N (Na, K, Rb i Cs nie tworzą stabilnych azotków ze względów sterycznych) i M 3 N 2 (M = Be, Mg, Ca, Sr, Ba). Można je formalnie traktować jako sole anionu N 3− , chociaż separacja ładunku nie jest w rzeczywistości kompletna nawet w przypadku tych wysoce elektrododatnich pierwiastków. Natomiast azydki metali alkalicznych NaN 3 i KN 3 , zawierające liniowy anion N
- 3 , są dobrze znane, podobnie jak Sr(N 3 ) 2 i Ba(N 3 ) 2 . Azydki metali z podgrupy B (te z grup od 11 do 16 ) są znacznie mniej jonowe, mają bardziej skomplikowaną strukturę i łatwo wybuchają po wstrząsie.
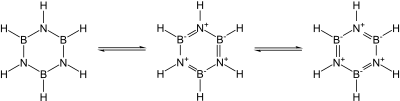
Znanych jest wiele kowalencyjnych azotków binarnych. Przykłady obejmują cyjan ((CN) 2 ), pentaazotek trifosforu (P 3 N 5 ), diazotek disiarki (S 2 N 2 ) i tetraazotek tetrasiarki (S 4 N 4 ). Zasadniczo kowalencyjny azotek krzemu (Si 3 N 4 ) i azotek germanu (Ge 3 N 4 ) są również znane: w szczególności azotek krzemu byłby obiecującą ceramiką , gdyby nie trudność w obróbce i spiekaniu go. W szczególności grupy 13 , z których większość to obiecujące półprzewodniki , są izoelektroniczne z grafitem, diamentem i węglikiem krzemu i mają podobną strukturę: ich wiązanie zmienia się z kowalencyjnego na częściowo jonowe i metaliczne w miarę opadania grupy. W szczególności, ponieważ jednostka B – N jest izoelektroniczna w stosunku do C – C, a węgiel ma zasadniczo wielkość pośrednią między borem a azotem, znaczna część chemii organicznej znajduje echo w chemii boru i azotu, na przykład w borazynie („nieorganiczny benzen ”). Niemniej jednak analogia nie jest dokładna ze względu na łatwość nukleofilowego na bor z powodu jego niedoboru elektronów, co nie jest możliwe w pierścieniu całkowicie zawierającym węgiel.
Największą kategorią azotków są azotki śródmiąższowe o wzorach MN, M2N i M4N ( chociaż zmienny skład jest całkowicie możliwy), w których małe atomy azotu są umieszczone w szczelinach metalicznej sześciennej lub sześciokątnej gęsto upakowanej sieci . Są nieprzezroczyste, bardzo twarde i obojętne chemicznie, topiąc się tylko w bardzo wysokich temperaturach (na ogół powyżej 2500 ° C). Mają metaliczny połysk i przewodzą prąd elektryczny, podobnie jak metale. Hydrolizują bardzo powoli, dając amoniak lub azot.
Anion azotkowy (N 3− ) jest najsilniejszym znanym donorem π wśród ligandów (drugim najsilniejszym jest O 2− ). Kompleksy nitridowe są na ogół wytwarzane w wyniku termicznego rozkładu azydków lub deprotonowania amoniaku i zwykle obejmują końcową grupę {≡N} 3− . Liniowy anion azydkowy ( N
- 3 ), będący izoelektroniczny z podtlenkiem azotu , dwutlenkiem węgla i cyjanianem , tworzy wiele kompleksów koordynacyjnych. Dalsza katenacja jest rzadka, chociaż N
4− 4 (izoelektroniczny z węglanem i azotanem ) jest znany.
wodorki
W przemyśle amoniak (NH 3 ) jest najważniejszym związkiem azotu i jest wytwarzany w większych ilościach niż jakikolwiek inny związek, ponieważ w znacznym stopniu przyczynia się do zaspokojenia potrzeb żywieniowych organizmów lądowych, służąc jako prekursor pożywienia i nawozów. Jest to bezbarwny gaz alkaliczny o charakterystycznym ostrym zapachu. Obecność wiązań wodorowych ma bardzo znaczący wpływ na amoniak, nadając mu wysokie temperatury topnienia (-78 ° C) i wrzenia (-33 ° C). Jako ciecz jest bardzo dobrym rozpuszczalnikiem o dużym cieple parowania (pozwalającym na stosowanie go w kolbach próżniowych), ma również niską lepkość i przewodność elektryczną oraz wysoką stałą dielektryczną i ma mniejszą gęstość niż woda. Jednak wiązanie wodorowe w NH 3 jest słabsze niż w H 2 O ze względu na niższą elektroujemność azotu w porównaniu z tlenem i obecność tylko jednej wolnej pary w NH 3 zamiast dwóch w H 2 O. Jest to słaba zasada w roztworze wodnym ( p Kb 4,74 ); jego sprzężonym kwasem jest amon , NH
+ 4 . Może również działać jako wyjątkowo słaby kwas, proton w celu wytworzenia anionu amidowego, NH- tracąc
2 . W ten sposób ulega samodysocjacji, podobnie jak woda, z wytworzeniem amoniaku i amidu. Amoniak spala się w powietrzu lub tlenie, choć nie łatwo, tworząc gazowy azot; spala się we fluorze zielonkawo-żółtym płomieniem, dając trójfluorek azotu . Reakcje z innymi niemetalami są bardzo złożone i zwykle prowadzą do powstania mieszaniny produktów. Amoniak reaguje podczas ogrzewania z metalami, dając azotki.
Znanych jest wiele innych dwuskładnikowych wodorków azotu, ale najważniejsze to hydrazyna (N 2 H 4 ) i azydek wodoru (HN 3 ). Chociaż nie jest to wodorek azotu, hydroksyloamina (NH 2 OH) ma podobne właściwości i strukturę do amoniaku i hydrazyny. Hydrazyna to dymiąca, bezbarwna ciecz o zapachu podobnym do amoniaku. Jego właściwości fizyczne są bardzo podobne do wody (temperatura topnienia 2,0 °C, temperatura wrzenia 113,5 °C, gęstość 1,00 g/cm 3 ). Pomimo tego, że jest związkiem endotermicznym, jest stabilny kinetycznie. Spala się szybko i całkowicie w powietrzu, bardzo egzotermicznie, dając azot i parę wodną. Jest bardzo użytecznym i wszechstronnym środkiem redukującym i jest słabszą zasadą niż amoniak. Jest również powszechnie stosowany jako paliwo rakietowe.
Hydrazyna jest generalnie wytwarzana w reakcji amoniaku z alkalicznym podchlorynem sodu w obecności żelatyny lub kleju:
- NH 3 + OCl − → NH 2 Cl + OH −
- NH 2 Cl + NH 3 → N
2 H
+ 5 + Cl − (wolno) -
N
2 H
+ 5 + OH − → N 2 H 4 + H 2 O (szybko)
(Ataki wodorotlenku i amoniaku można odwrócić, przechodząc w ten sposób przez pośredni NHCl - zamiast.) Powodem dodania żelatyny jest to, że usuwa ona jony metali, takie jak Cu 2+ , który katalizuje rozkład hydrazyny w reakcji z monochloraminą (NH 2 Cl) do produkcji chlorku amonu i azotu.
Azydek wodoru (HN 3 ) został po raz pierwszy wyprodukowany w 1890 r. przez utlenianie wodnego roztworu hydrazyny kwasem azotawym. Jest bardzo wybuchowy i nawet rozcieńczone roztwory mogą być niebezpieczne. Ma nieprzyjemny i drażniący zapach i jest potencjalnie śmiertelną (ale nie kumulacyjną) trucizną. Można go uznać za sprzężony kwas anionu azydkowego i jest podobnie analogiczny do kwasów halogenowodorowych .
Halogenki i oksohalogenki
Znane są wszystkie cztery proste trihalogenki azotu. Znanych jest kilka mieszanych halogenków i halogenowodorków, ale są one w większości niestabilne; przykłady NFH2 obejmują NClF2 , NCl2F , NBrF2 , NF2H , , NCl2H _ _ i NClH2 . _
Znanych jest pięć fluorków azotu. Trifluorek azotu (NF 3 , po raz pierwszy wytworzony w 1928 r.) jest bezbarwnym i bezwonnym gazem, który jest stabilny termodynamicznie i najłatwiej wytwarzany przez elektrolizę stopionego fluorku amonu rozpuszczonego w bezwodnym fluorowodorze . Podobnie jak czterofluorek węgla , nie jest w ogóle reaktywny i jest stabilny w wodzie lub rozcieńczonych wodnych kwasach lub zasadach. Dopiero po podgrzaniu działa jako środek fluorujący i reaguje z miedzią , arsen, antymon i bizmut w kontakcie w wysokich temperaturach z wytworzeniem tetrafluorohydrazyny (N 2 F 4 ). Znane są również kationy NF
+ 4 i N
2 F
+ 3 (ten ostatni z reakcji tetrafluorohydrazyny z silnymi akceptorami fluoru, takimi jak pentafluorek arsenu ), podobnie jak ONF 3 , co wzbudziło zainteresowanie ze względu na krótką odległość N – O implikującą częściowe wiązanie podwójne oraz wysoce polarne i długie wiązanie N – F. Tetrafluorohydrazyna, w przeciwieństwie do samej hydrazyny, może dysocjować w temperaturze pokojowej i wyższej, dając rodnik NF 2 •. Azydek fluoru (FN 3 ) jest bardzo wybuchowy i nietrwały termicznie. Difluorek diazotu (N 2 F 2 ) występuje w postaci termicznie przekształcalnych izomerów cis i trans i po raz pierwszy został znaleziony jako produkt rozkładu termicznego FN 3 .
Trójchlorek azotu (NCl 3 ) jest gęstą, lotną i wybuchową cieczą, której właściwości fizyczne są podobne do tetrachlorku węgla , chociaż jedną różnicą jest to, że NCl 3 jest łatwo hydrolizowany przez wodę, podczas gdy CCl 4 nie. Po raz pierwszy został zsyntetyzowany w 1811 roku przez Pierre'a Louisa Dulonga , który stracił trzy palce i oko z powodu jego wybuchowych tendencji. Jako gaz rozcieńczony jest mniej niebezpieczny i dlatego jest używany przemysłowo do wybielania i sterylizacji mąki. Trójbromek azotu (NBr 3 ), przygotowany po raz pierwszy w 1975 roku, jest ciemnoczerwonym, wrażliwym na temperaturę, lotnym ciałem stałym, które wybucha nawet w temperaturze -100 ° C. Trójjodek azotu (NI 3 ) jest jeszcze bardziej nietrwały i został przygotowany dopiero w 1990 roku. Znany wcześniej jego addukt z amoniakiem jest bardzo wrażliwy na wstrząsy: można go wyzwolić dotknięciem pióra, zmieniającymi się prądami powietrza lub nawet cząstki alfa . Z tego powodu małe ilości trójjodku azotu są czasami syntetyzowane jako demonstracja dla uczniów chemii w liceum lub jako akt „magii chemicznej”. Azydek chloru (ClN 3 ) i azydek bromu (BrN 3 ) są niezwykle wrażliwe i wybuchowe.
Znane są dwie serie tlenohalogenków azotu: halogenki nitrozylu (XNO) i halogenki nitrylu (XNO 2 ). Pierwsze to bardzo reaktywne gazy, które można wytworzyć przez bezpośrednie halogenowanie podtlenku azotu. Fluorek nitrozylu (NOF) jest bezbarwnym i silnym środkiem fluorującym. Chlorek nitrozylu (NOCl) zachowuje się w podobny sposób i był często używany jako rozpuszczalnik jonizujący. Bromek nitrozylu (NOBr) ma kolor czerwony. Reakcje halogenków nitrylu są w większości podobne: fluorek nitrylu (FNO 2 ) i chlorek nitrylu (ClNO 2 ) są podobnie reaktywnymi gazami i silnymi środkami halogenującymi.
tlenki
Azot tworzy dziewięć tlenków cząsteczkowych, z których niektóre były pierwszymi zidentyfikowanymi gazami: N 2 O ( tlenek azotu ), NO ( tlenek azotu ), N 2 O 3 ( trójtlenek azotu ), NO 2 ( dwutlenek azotu ), N 2 O 4 ( tetratlenek diazotu ), N 2 O 5 ( pięciotlenek diazotu ), N 4 O ( nitrozylazydek ) i N (NO 2 ) 3 ( trinitramid ). Wszystkie są niestabilne termicznie w kierunku rozkładu na ich pierwiastki. Innym możliwym tlenkiem, który nie został jeszcze zsyntetyzowany, jest oksatetrazol (N 4 O), pierścień aromatyczny.
Podtlenek azotu (N 2 O), lepiej znany jako gaz rozweselający, powstaje w wyniku termicznego rozkładu stopionego azotanu amonu w temperaturze 250°C. Jest to reakcja redoks, a zatem jako produkty uboczne powstają również tlenek azotu i azot. Jest używany głównie jako propelent i środek napowietrzający do bitej śmietany w sprayu w puszkach , a wcześniej był powszechnie stosowany jako środek znieczulający. Wbrew pozorom nie można go uznać za bezwodnik kwasu podazotawego (H 2 N 2 O 2 ), ponieważ ten kwas nie powstaje w wyniku rozpuszczania podtlenku azotu w wodzie. Jest raczej niereaktywny (nie reaguje z halogenami, metalami alkalicznymi ani ozonem w temperaturze pokojowej, chociaż reaktywność wzrasta po podgrzaniu) i ma niesymetryczną strukturę N – N – O ( N ≡ N + O - ↔ - N = N + = O): powyżej 600 ° C dysocjuje poprzez zerwanie słabszego wiązania N – O. Tlenek azotu (NO) jest najprostszą stabilną cząsteczką o nieparzystej liczbie elektronów. U ssaków, w tym ludzi, jest ważną komórkową cząsteczką sygnałową uczestniczy w wielu procesach fizjologicznych i patologicznych. Powstaje w wyniku katalitycznego utleniania amoniaku. Jest to bezbarwny gaz paramagnetyczny, który będąc niestabilnym termodynamicznie, rozkłada się na gazowy azot i tlen w temperaturze 1100–1200 ° C. Jego wiązanie jest podobne do tego w azocie, ale jeden dodatkowy elektron jest dodawany do π *, a zatem kolejność wiązań została zmniejszona do około 2,5; stąd dimeryzacja do O = N – N = O jest niekorzystna, z wyjątkiem sytuacji poniżej temperatury wrzenia (gdzie cis izomer jest bardziej stabilny), ponieważ w rzeczywistości nie zwiększa całkowitej kolejności wiązań i ponieważ niesparowany elektron jest przemieszczany w poprzek cząsteczki NO, co zapewnia jej stabilność. Istnieją również dowody na asymetryczny czerwony dimer O = N – O = N, gdy tlenek azotu jest skondensowany z cząsteczkami polarnymi. Reaguje z tlenem, dając brązowy dwutlenek azotu, a z halogenami, dając halogenki nitrozylu. Reaguje również ze związkami metali przejściowych, dając kompleksy nitrozylowe, z których większość jest głęboko zabarwiona.
Niebieski tritlenek diazotu (N 2 O 3 ) jest dostępny tylko w postaci stałej, ponieważ szybko dysocjuje powyżej swojej temperatury topnienia, dając tlenek azotu, dwutlenek azotu (NO 2 ) i tetratlenek diazotu (N 2 O 4 ). Te dwa ostatnie związki są nieco trudne do zbadania indywidualnie ze względu na równowagę między nimi, chociaż czasami tetratlenek diazotu może reagować przez rozszczepienie heterolityczne na nitrozon i azotan w ośrodku o dużej stałej dielektrycznej. Dwutlenek azotu jest gryzącym, żrącym brązowym gazem. Oba związki można łatwo otrzymać przez rozkład suchego azotanu metalu. Oba reagują z wodą, tworząc kwas azotowy . Czterotlenek diazotu jest bardzo przydatny do wytwarzania bezwodnych azotanów metali i kompleksów azotanowych, a pod koniec lat pięćdziesiątych XX wieku stał się preferowanym utleniaczem do przechowywania w wielu rakietach zarówno w Stanach Zjednoczonych, jak i ZSRR . Dzieje się tak, ponieważ jest to hipergoliczny propelent w połączeniu z paliwem rakietowym na bazie hydrazyny i może być łatwo przechowywany, ponieważ jest płynny w temperaturze pokojowej.
Termicznie nietrwały i bardzo reaktywny pięciotlenek diazotu (N 2 O 5 ) jest bezwodnikiem kwasu azotowego i można go otrzymać przez odwodnienie pięciotlenkiem fosforu . Jest to interesujące dla przygotowania materiałów wybuchowych. Jest to rozpływające się , bezbarwne krystaliczne ciało stałe, które jest wrażliwe na światło. W stanie stałym jest jonowy o strukturze [NO 2 ] + [NO 3 ] − ; jako gaz iw roztworze jest cząsteczkowym O 2 N–O–NO 2 . Hydratacja do kwasu azotowego zachodzi łatwo, podobnie jak analogiczna reakcja z nadtlenkiem wodoru dająca kwas peroksonitowy (HOONO 2 ). Jest to silny środek utleniający. Gazowy pięciotlenek diazotu rozkłada się w następujący sposób:
- N 2 O 5 ⇌ NIE 2 + NIE 3 → NIE 2 + O 2 + NIE
- N 2 O 5 + NIE ⇌ 3 NIE 2
Oksokwasy, oksoaniony i sole oksokwasów
wiele oksokwasów azotowych , chociaż większość z nich jest niestabilna jako czyste związki i jest znana tylko jako roztwór wodny lub sole. Kwas podazotawy (H 2 N 2 O 2 ) jest słabym kwasem diprotonowym o budowie HON=NOH (p Ka1 6,9 , p Ka2 11,6 ). Kwaśne roztwory są dość stabilne, ale powyżej pH 4 następuje katalizowany zasadą rozkład poprzez [HONNO] − do podtlenku azotu i anionu wodorotlenkowego. Podazotyny (zawierające N
2 O 2-2
. aniony) są stabilne w stosunku do środków redukujących i częściej same działają jako środki redukujące Stanowią pośredni etap utleniania amoniaku do azotynów, który zachodzi w cyklu azotowym . Podazotyn może działać jako dwukleszczowy ligand mostkujący lub chelatujący.
Kwas azotawy (HNO 2 ) nie jest znany jako czysty związek, ale jest powszechnym składnikiem równowagi gazowej i jest ważnym odczynnikiem wodnym: jego wodne roztwory można sporządzić z zakwaszających chłodnych wodnych roztworów azotynów ( NO
− 2 , zgięty), chociaż już w temperaturze pokojowej dysproporcja do azotanów i tlenku azotu jest znacząca. Jest to słaby kwas o p K a 3,35 w temperaturze 18 ° C. Można je miareczkowo poprzez ich utlenianie do azotanów nadmanganianem . Łatwo ulegają redukcji do podtlenku azotu i tlenku azotu przez dwutlenek siarki , do kwasu podazotawego przez cynę (II) i do amoniaku przez siarkowodór . Sole hydrazyny N
2 H
+ 5 reagują z kwasem azotawym, tworząc azydki, które dalej reagują dając podtlenek azotu i azot. Azotan sodu jest lekko toksyczny w stężeniach powyżej 100 mg / kg, ale niewielkie ilości są często używane do peklowania mięsa i jako środek konserwujący, aby uniknąć psucia się bakterii. Jest również używany do syntezy hydroksyloaminy i diazowania pierwszorzędowych amin aromatycznych w następujący sposób:
- ArNH2 + HNO2 → [ ArNN ]Cl + 2H2O
Azotyn jest również powszechnym ligandem, który może koordynować na pięć sposobów. Najczęstsze to nitro (powiązane z azotem) i nitryto (powiązane z tlenem). Izomeria nitro-nitrytonowa jest powszechna, gdzie forma nitrytonowa jest zwykle mniej stabilna.
Kwas azotowy (HNO 3 ) jest zdecydowanie najważniejszym i najbardziej stabilnym oksokwasem azotowym. Jest to jeden z trzech najczęściej używanych kwasów (pozostałe dwa to kwas siarkowy i kwas solny ) i został odkryty przez alchemików w XIII wieku. Powstaje w wyniku katalitycznego utleniania amoniaku do tlenku azotu, który jest utleniany do dwutlenku azotu, a następnie rozpuszczany w wodzie z wytworzeniem stężonego kwasu azotowego. W Stanach Zjednoczonych Ameryki , każdego roku produkuje się ponad siedem milionów ton kwasu azotowego, z czego większość jest wykorzystywana między innymi do produkcji azotanów do nawozów i materiałów wybuchowych. Bezwodny kwas azotowy można otrzymać przez destylację stężonego kwasu azotowego z pięciotlenkiem fosforu pod niskim ciśnieniem w szklanym aparacie w ciemności. Można go wytworzyć tylko w stanie stałym, ponieważ po stopieniu samoistnie rozkłada się do dwutlenku azotu, a ciekły kwas azotowy ulega samojonizacji w większym stopniu niż jakakolwiek inna ciecz kowalencyjna w następujący sposób:
- 2 HNO 3 ⇌ H
2 NIE
+ 3 + NIE
- 3 ⇌ H 2 O + [NIE 2 ] + + [NIE 3 ] -
dwa hydraty, HNO 3 ·H 2 O i HNO 3 · 3H 2 O, które mogą krystalizować. Jest silnym kwasem, a stężone roztwory są silnymi utleniaczami, chociaż złoto , platyna , rod i iryd są odporne na atak. Mieszanina 3:1 stężonego kwasu solnego i kwasu azotowego, zwana aqua regia , jest jeszcze silniejszy i skutecznie rozpuszcza złoto i platynę, ponieważ powstaje wolny chlor i chlorek nitrozylu, a aniony chlorkowe mogą tworzyć silne kompleksy. W stężonym kwasie siarkowym kwas azotowy jest protonowany, tworząc nitron , który może działać jako elektrofil w nitrowaniu aromatycznym:
- HNO 3 + 2 H 2 SO 4 ⇌ NIE
+ 2 + H 3 O + + 2 H SO
- 4
Stabilność termiczna azotanów (obejmująca trygonalny płaski anion NO
- 3 ) zależy od zasadowości metalu, podobnie jak produkty rozkładu (termolizy), które mogą różnić się między azotynem (na przykład sodem), tlenkiem ( potas i ołów ), a nawet sam metal ( srebro ), w zależności od ich względnej stabilności. Azotan jest również powszechnym ligandem o wielu trybach koordynacji.
Wreszcie, chociaż kwas ortoazotowy (H 3 NO 4 ), który byłby analogiczny do kwasu ortofosforowego , nie istnieje, tetraedryczny anion ortoazotanowy NO
3− 4 jest znany w swoich solach sodowych i potasowych:
Te białe krystaliczne sole są bardzo wrażliwe na parę wodną i dwutlenek węgla w powietrzu:
- Na3NO4 + H2O + CO2 → NaNO3 + NaOH + NaHCO3 _
Pomimo ograniczonej chemii anion ortoazotanowy jest interesujący ze strukturalnego punktu widzenia ze względu na jego regularny czworościenny kształt i krótkie długości wiązań N – O, co sugeruje znaczący polarny charakter wiązania.
Organiczne związki azotu
Azot jest jednym z najważniejszych pierwiastków w chemii organicznej . Wiele organicznych grup funkcyjnych obejmuje wiązanie węgiel-azot , takie jak amidy (RCONR 2 ), aminy (R 3 N), iminy (RC(=NR)R), imidy (RCO) 2 NR, azydki (RN 3 ), azo związki (RN 2 R), cyjaniany i izocyjaniany (ROCN lub RCNO), azotany (RONO 2 ), nitryle i izonitryle (RCN lub RNC), azotyny (RONO), nitrozwiązki (RNO 2 ), związki nitrozowe (RNO), oksymy (RCR=NOH) i pochodne pirydyny . Wiązania C-N są silnie spolaryzowane w kierunku azotu. W tych związkach azot jest zwykle trójwartościowy (chociaż może być czterowartościowy w czwartorzędowych solach amoniowych , R 4 N + ), z samotną parą, która może nadawać związkowi zasadowość poprzez koordynację z protonem. Można to zrównoważyć innymi czynnikami: na przykład amidy nie są zasadowe, ponieważ samotna para jest zdelokalizowana do wiązania podwójnego (chociaż mogą działać jak kwasy przy bardzo niskim pH, będąc protonowanymi przy atomie tlenu), a pirol nie jest kwaśny , ponieważ samotna para jest zdelokalizowana jako część pierścienia aromatycznego . Ilość azotu w substancji chemicznej można określić metodą Kjeldahla . W szczególności azot jest niezbędnym składnikiem kwasów nukleinowych , aminokwasy , a tym samym białka , oraz cząsteczkę przenoszącą energię trifosforan adenozyny , a zatem jest niezbędna dla wszelkiego życia na Ziemi.




![{\displaystyle {\ce {NaNO3{}+Na2O->[{\ce {Ag~crucible}}][{\ce {300^{\circ }C~for~7days}}]Na3NO4}}}](https://wikimedia.org/api/rest_v1/media/math/render/svg/ec729bc88f520e08fdce8a013dec8ae601d28509)