Ługdunin
|
|
| Nazwy | |
|---|---|
|
nazwa IUPAC
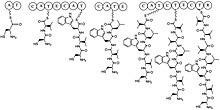
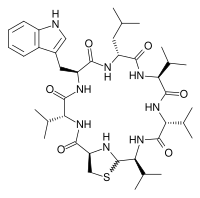
(1R , 4R , 7S ,10R , 13S , 16R , 19S ) -7-(1H - indol-3-ilometylo)-10-izobutylo-4,13,16,19- tetraizopropylo- 21-tia-3,6,9,12,15,18,23-heptaazabicyklo[18.2.1]trikozan-2,5,8,11,14,17-hekson
|
|
| Identyfikatory | |
|
Model 3D ( JSmol )
|
|
| CHEBI | |
| ChemSpider | |
|
Identyfikator klienta PubChem
|
|
|
|
|
|
| Nieruchomości | |
| C40H62N8O6S _ _ _ _ _ _ _ _ | |
| Masa cząsteczkowa | 783,05 g·mol -1 |
|
O ile nie zaznaczono inaczej, dane podano dla materiałów w stanie normalnym (przy 25°C [77°F], 100 kPa).
|
|
Lugdunina jest eksperymentalnym antybiotykiem , sklasyfikowanym jako cykliczny peptyd zawierający tiazolidynę . Został wyizolowany w 2016 roku po Staphylococcus lugdunensis jako gatunku bakterii z ludzkiego nosa , który hamował wzrost gatunków bakterii chorobotwórczych w tej części ludzkiego mikrobiomu .
Lugdunina jest nie syntetyzowanym rybosomalnie cyklicznym peptydem, który hamuje wzrost szczepów Staphylococcus aureus . Geny lugdunin znajdują się na operonie o wielkości 30 kbp . Geny lugA , lugB , lugC i lugD kodują cztery nierybosomalne syntazy peptydowe , które są poprzedzone przypuszczalnym genem regulatorowym lugR .
| Gen | szarańcza | wielkość białka/aa | Wpis białka Genbank | Wpis białka RefSeq |
|---|---|---|---|---|
| lugR | SLUG_RS03935 | 196 | CCB53263.1 | WP_002460032.1 |
| lugA | SLUG_RS03940 | 2374 | CCB53264.1 | WP_002478842.1 |
| SLUG_RS03945 | 124 | CCB53265.1 | WP_002460029.1 | |
| lugB | SLUG_RS03950 | 1230 | CCB53266.1 | WP_014533237.1 |
| ucho C | SLUG_RS03955 | 2937 | CCB53267.1 | WP_002478844.1 |
| lugT | SLUG_RS03960 | 228 | CCB53268.1 | WP_002460022.1 |
| lugD | SLUG_RS03965 | 579 | CCB53269.1 | WP_002478846.1 |
Biosynteza
Lugdunina jest syntetyzowana przez nierybosomalne syntetazy peptydowe w S. lugdunensis . Cząsteczka jest cyklicznym peptydem złożonym z heterocyklu tiazolidyny i trzech aminokwasów D. Operon odpowiedzialny za syntezę lugduniny ma około 30 kb i zawiera cztery nierybosomalne syntetazy peptydowe geny. Operon zawiera transferazę fosfopanteteinylową, monooksygenazę, nieznany enzym dopasowujący, gen regulatorowy i tioesterazę typu II. Fosfopanteteinylowe transferazy przeprowadzają aktywację domen T, które działają jako białka nośnikowe. Monooksygenazy włączają pojedynczą grupę hydroksylową do półproduktu lugduniny. Tioesteraza typu II jest wykorzystywana do usuwania związków pośrednich, które zatrzymują się podczas biosyntezy. [ potrzebne źródło ]
Zaskakującą uwagą dotyczącą lugduniny jest to, że operon koduje tylko pięć domen adenylacyjnych , co jest interesująco małą ilością jak na tak dużą cząsteczkę. Ta rozbieżność jest wyjaśniona przez dodanie trzech kolejnych reszt waliny w naprzemiennych konfiguracjach D i L przez LugC. Pierścień tiazolidynowy tworzy się po uwolnieniu metabolitu poprzez redukcję. N-końcowa reszta L-cysteiny nukleofilowo atakuje karbonyl na C-końcowej reszcie L-waliny, tworząc w ten sposób makrocykl iminowy. Baza Schiffa utworzony w tej reakcji jest następnie nukleofilowo atakowany przez tiol cysteiny, który wytwarza opisany wcześniej heterocykl tiazolidyny. [ potrzebne źródło ]
- ^ Gallagher, James (27.07.2016). „Odporność na antybiotyki: badanie„ wojny smarków ”zwiastuje nową klasę leków” . wiadomości BBC . Źródło 2016-07-27 .
- ^ Zamek błyskawiczny, Aleksander; Konnerth, Martin C.; Laux, Klaudia; Berscheid, Anna; Janek, Daniela; Weidenmaier, Christopher; Burian, Marc; Schilling, Nadine A.; Slavetinsky, Christoph (2016). „Ludzkie komensale produkujące nowy antybiotyk osłabiają kolonizację patogenów”. Natura . 535 (7613): 511–516. Bibcode : 2016Natur.535..511Z . doi : 10.1038/natura18634 . PMID 27466123 . S2CID 205249755 .
- ^ „Naukowcy znajdują mikrobiotyczny skarb ukryty w nosie” . Los Angeles Times . 2016-07-27 . Źródło 2016-07-27 .
- ^ Krismer, Bernhard; Peschel, Andreas; Grond, Stephanie; Brötz-Oesterhelt, Heike; Schittek, Birgit; Kalbacher, Hubert; Willmann, Matthias; Marszałek Maciej; Slavetinsky, Christoph; Schilling, Nadine A.; Burian, Marc; Weidenmaier, Christopher; Janek, Daniela; Berscheid, Anna; Laux, Klaudia; Konnerth, Martin C.; Zamek błyskawiczny, Alexander (lipiec 2016). „Dane rozszerzone, rysunek 1: klaster genów lugduniny i generacja S. lugdunensis IVK28-Xyl” . Natura . 535 (7613): 511–516. Bibcode : 2016Natur.535..511Z . doi : 10.1038/natura18634 . PMID 27466123 . S2CID 205249755 .
- ^ Krauss, Zofia; Zipperer, Aleksander; Wirtz, Sebastian; Saur, Julian; Konnerth, Martin C.; Heilbronner, Szymon; Torres Salazar, Benjamin O.; Grond, Stephanie; Krismer, Bernhard; Peschel, Andreas (2020-12-16). „Wydzielanie i samoodporność na nowy fibupeptyd przeciwdrobnoustrojowy Lugdunina przez odrębne transportery ABC w Staphylococcus lugdunensis” . Środki przeciwdrobnoustrojowe i chemioterapia . 65 (1): e01734–20. doi : 10.1128/AAC.01734-20 . ISSN 0066-4804 . PMC 7927808 . PMID 33106269 .
- ^ „Lugdunin - przegląd | Tematy ScienceDirect” . www.sciencedirect.com . Źródło 2022-06-04 .
Linki zewnętrzne
- „Informacja prasowa: Potencjalny ratownik leży nierozpoznany w ludzkim ciele” (PDF) . www.uni-tuebingen.de . Uniwersytet w Tybindze . Źródło 2016-07-28 .