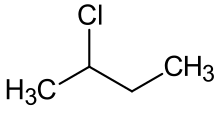
2-chlorobutan
|
|
| Nazwy | |
|---|---|
|
Preferowana nazwa IUPAC
2-chlorobutan |
|
| Identyfikatory | |
|
|
|
Model 3D ( JSmol )
|
|
| CHEBI | |
| CHEMBL | |
| ChemSpider | |
| Karta informacyjna ECHA | 100.001.047 |
| Numer WE |
|
|
Identyfikator klienta PubChem
|
|
| UNII |
|
|
Pulpit nawigacyjny CompTox ( EPA )
|
|
|
|
|
|
| Nieruchomości | |
| C4H9Cl _ _ _ _ | |
| Masa cząsteczkowa | 92,57 g·mol -1 |
| Gęstość | 0,873 g cm -3 |
| Temperatura topnienia | -140 ° C (-220 ° F; 133 K) |
| Temperatura wrzenia | 70 ° C (158 ° F; 343 K) |
| -67,40· 10-6 cm3 / mol | |
| Zagrożenia | |
| Oznakowanie GHS : | |
 
|
|
| Niebezpieczeństwo | |
| H225 , H315 , H319 , H335 | |
| P210 , P233 , P240 , P241 , P242 , P243 , P261 , P264 , P271 , P280 , P302+P352 , P303+P361+P353 , P304+P340 , P305 + P351+P338 , P312 , P3 21 , P332 + P313 , P337+ P313 , P362 , P370+P378 , P403+P233 , P403+P235 , P405 , P501 | |
|
O ile nie zaznaczono inaczej, dane podano dla materiałów w stanie normalnym (przy 25°C [77°F], 100 kPa).
|
|
2-Chlorobutan jest związkiem o wzorze C 4 H 9 Cl . Jest również nazywany chlorkiem sec-butylu. Jest to bezbarwna, lotna ciecz w temperaturze pokojowej, która nie miesza się z wodą.
Właściwości fizyczne
Jest to bezbarwna, lotna ciecz w temperaturze pokojowej, która nie miesza się z wodą. Będąc chlorkiem alkilu, jego temperatura wrzenia zmienia się w zależności od tego, jaki rodzaj halogenku jest przyłączony i gdzie jest przyłączony. Temperatury wrzenia chlorków są niższe niż bromków lub jodków ze względu na mały rozmiar chloru w stosunku do innych halogenów i jego słabsze siły międzycząsteczkowe.
Pomimo swojej polarności, 2-chlorobutan jest tylko słabo rozpuszczalny w wodzie ze względu na łańcuch węglowodorowy, do którego jest przyłączony, co czyni go rozpuszczalnym w niepolarnych rozpuszczalnikach organicznych. Podobnie jak wiele halogenków alkilowych, jest reaktywny w teorii względności, chociaż nie tak reaktywny jak jodki i bromki (I>Br>Cl>F), z powodu tej reaktywności fluorki alkilu są bardziej stabilne niż inne i nie są łatwo reaktywne.
Synteza
2-Chlorobutan można zsyntetyzować przez dodanie kwasu solnego do 2-butenu w następującej reakcji:
Reakcja jest dwuetapowa, w której elektrony pi atakują wodór chlorkowy, który tworzy nukleofil chlorkowy . W drugim etapie nukleofil atakuje karbokation wygenerowany w pierwszym etapie.
Chociaż dodanie halogenowodoru do alkenu jest stereoselektywne , symetryczna struktura 2-butenu zapobiega tworzeniu się produktu anty-Marknikowa, ponieważ obie strony podwójnego wiązania mają taką samą stabilność.
Ponadto 2-chlorobutan można zsyntetyzować w reakcji podstawienia w reakcji 2-butanolu z kwasem solnym.
W tym przypadku reakcja to SN1, ponieważ 2-butanol generuje karbokation w reakcji dwuetapowej. Ponieważ hydroksylowa nie jest dobrą grupą opuszczającą, najpierw atakuje wodór chlorkowy, tworząc wodę, która jest dobrą grupą opuszczającą, co generuje karbokation. W drugim etapie nukleofil chlorkowy atakuje karbokation, tworząc produkt.
2-Chlorobutan, wraz z innymi halogenkami alkilowymi, jest użytecznym związkiem pośrednim w wielu różnych reakcjach organicznych. Grupa halogenowa jest skuteczną grupą opuszczającą, co prowadzi do jej zastosowania zarówno w reakcjach eliminacji, jak i podstawienia. Ponadto związek ten jest również kandydatem do reakcji sprzęgania za pośrednictwem odczynnika Grignarda .
Używa
2-Chlorobutan wraz z innymi halogenkami alkilowymi jest użytecznym związkiem pośrednim w wielu różnych reakcjach organicznych. Grupa halogenowa jest skuteczną grupą opuszczającą, co prowadzi do jej zastosowania zarówno w reakcjach eliminacji, jak i podstawienia. Ponadto związek jest również kandydatem do reakcji sprzęgania za pośrednictwem odczynnika Grignarda.
Reakcje podstawienia
2-Chlorobutan wraz z innymi halogenkami alkilowymi jest użytecznym związkiem pośrednim w wielu różnych reakcjach organicznych. Grupa halogenowa jest skuteczną grupą opuszczającą, co prowadzi do jej zastosowania zarówno w reakcjach eliminacji, jak i podstawienia. Ponadto związek jest również kandydatem do reakcji sprzęgania za pośrednictwem odczynnika Grignarda. W reakcji Sn2 nukleofil (jod) atakuje częściowo dodatni węgiel, co eliminuje chlor. Dzieje się to w jednym kroku.
Mniej korzystną, ale wciąż możliwą reakcją jest reakcja Sn1, w której po usunięciu grupy opuszczającej powstaje wtórny karbokation. Następnie nukleofil atakuje karbokation, tworząc produkt.
Reakcje eliminacji
Dodatkowo, ponieważ 2-chlorobutan jest antyperiplanarny, może ulegać reakcjom eliminacji E2 z mocnymi zasadami. W nim grupa opuszczająca chlor jest usuwana, a podwójne wiązanie jest przywracane, dając różne izomery konstytucyjne2. Dzieje się tak, ponieważ 2-chlorobutan ma dwa różne zestawy β-wodorów odpowiednio przy pierwszym i trzecim atomie węgla, co daje 1-buten lub 2-buten. Należy zauważyć, że jako drugorzędowy halogenek alkilu, zarówno reakcje E2, jak i Sn2 są równie prawdopodobne, gdy reagują z substancją, która może działać zarówno jako zasada, jak i nukleofil. Która reakcja zachodzi, zależy od warunków otoczenia. W mechanizmie E2 mocna zasada (np. wodorotlenek sodu) odrywa beta wodór, powodując, że wybory z poprzedniego wiązania węgiel-wodór ponownie tworzą wiązanie podwójne. To działanie usuwa grupę opuszczającą, przekształcając 2-chlorobutan w 2-buten lub 1-buten, w zależności od tego, który beta wodór jest usuwany, ze względu na regułę Zajcewa preferowany jest bardziej stabilny produkt 2-butenowy.
Mechanizm powstawania 2-butenu (preferowany):
Mechanizm powstawania 1-butenu (niekorzystny):
Reakcje Grignarda
Jako halogenek alkilu, 2-chlorobutan można stosować do przygotowania odczynnika Grignarda do stosowania w tworzeniu wiązania węgiel-węgiel. W pierwszym etapie jon magnezu przekazuje elektron węglowi alfa w 2-chlorobutanie, usuwając chlor i tworząc rodnik allilowy oraz rodnik Mg+1. W drugim etapie rodnik Mg+1 łączy się z rodnikiem allilowym, podczas gdy jon chlorkowy oddziałuje z jonem magnezu.


