Zarośnięcie płuc z ubytkiem przegrody międzykomorowej
| Zarośnięcie płuc z ubytkiem przegrody międzykomorowej | |
|---|---|
| Inne nazwy | PA-VSDS (w skrócie) |
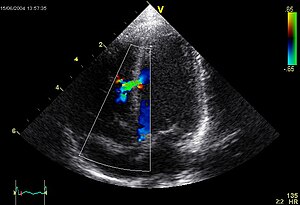 | |
| Ubytek przegrody międzykomorowej , jeden z objawów tej choroby, w badaniu USG . | |
| Specjalność | Genetyka medyczna |
| Czynniki ryzyka | Zwykle wchodzą w grę czynniki genetyczne i środowiskowe |
| Metoda diagnostyczna | Badania radiologiczne, takie jak tomografia komputerowa klatki piersiowej. |
| Diagnostyka różnicowa | Atrezja płuc |
| Rokowanie | biedny bez leczenia |
| Częstotliwość | rzadki |
| Zgony | nieleczeni pacjenci z PAVSD są bardziej narażeni na przedwczesną śmierć |
Atrezja płuc z ubytkiem przegrody międzykomorowej jest rzadką wadą wrodzoną charakteryzującą się atrezją zastawki płucnej towarzyszącą ubytkowi drogi odpływu prawej komory.
Jest to rodzaj wrodzonej choroby/wady serca i jeden z dwóch rozpoznanych podtypów atrezji płuc , drugim jest atrezja płuc z nienaruszoną przegrodą międzykomorową.
Symptomy i objawy
Choroba obejmuje atrezję wpływającą na zastawkę płucną i hipoplastyczną drogę odpływu prawej komory. Ubytek przegrody międzykomorowej nie utrudnia dopływu i odpływu krwi przez przegrodę międzykomorową, co ułatwia jej powstawanie w życiu płodowym.
Spektrum objawów wykazywanych przez dzieci z tą chorobą zależy od ciężkości choroby, podczas gdy u niektórych objawy są ledwo widoczne, u innych mogą wystąpić powikłania, takie jak zastoinowa niewydolność serca .
U dzieci z objawami objawy pojawiają się wkrótce po urodzeniu i zwykle obejmują:
- Sinica
- Trudności w oddychaniu
- Trudności w karmieniu
- Wyczerpanie podczas karmienia
- Szmer serca
- Nadmierna senność w ciągu dnia
- Lepka skóra
Oprócz tej wady wrodzonej mogą wystąpić inne cechy, w tym inne wady wrodzone, takie jak polidaktylia , małogłowie , wrodzona utrata słuchu (typu czuciowo-nerwowego), agenezja nerek , dekstrokardia itp.
Schorzenie to nazywa się ciężką formą tetralogii Fallota .
Jeśli obok tego schorzenia pojawią się zdeformowane naczynia krwionośne wychodzące z aorty piersiowej , nazwę fenotypu zmienia się na atrezję płucną z ubytkiem przegrody międzykomorowej i głównymi zabezpieczeniami aortalno-płucnymi.
Komplikacje
Dzieci cierpiące na tę chorobę są bardziej narażone na wystąpienie następujących powikłań:
- Brak prawidłowego rozwoju
- Nawracające infekcje klatki piersiowej
- Zapalenie wsierdzia
- Padaczka
- Udar
- Niemiarowość
- Niewydolność serca
- Przedwczesna śmierć
Dzieci, u których PAVSD jest spowodowane zespołem DiGeorge'a (znanym również jako zespół delecji 22q11.2), są bardziej narażone na powikłania pooperacyjne (zwłaszcza oddechowe) związane z operacjami leczącymi tę wadę.
Kobiety chore na PAVSD są nieco bardziej narażone na niepłodność , poronienie lub urodzenie dziecka z wrodzoną wadą serca.
Nadreaktywność oskrzeli jest powszechnie występującą chorobą współistniejącą u osób cierpiących na PAVSD.
Patogeneza
Zarośnięcie płuc w PAVSD ma miejsce w ciągu pierwszych 8 tygodni życia płodowego, kiedy to zastawka płucna, która powinna się uformować, nie tworzy się, co uniemożliwia przepływ krwi przez tętnicę płucną z prawej komory. Ubytek przegrody międzykomorowej związany z PAVSD umożliwia utworzenie prawej komory.
W niektórych przypadkach PAVSD rozwijają się główne tętnice poboczne aortalno-płucne; u zdrowego płodu tętnice te zwykle się rozwijają, ale następnie zaczynają się pogarszać po rozroście tętnic płucnych, u płodów z PAVSD tętnice płucne nie rozwijają się, co daje szansę na pełny rozwój głównych tętnic pobocznych aortalno-płucnych.
Patofizjologia
Najłagodniejszy wariant atrezji płucnej z ubytkiem przegrody międzykomorowej obejmuje atrezję płucną z prawidłowo rozwiniętą główną tętnicą płucną i odgałęzionymi tętnicami płucnymi, krew napływająca do płuc z prawej strony serca przechodzi przez przegrodę międzykomorową do lewej strony serca który następnie przepływa przez przetrwały przewód tętniczy . Najcięższy wariant obejmuje obecność silnie hipoplastycznej głównej tętnicy płucnej i odgałęzionych tętnic płucnych wraz z agenezją przetrwałego przewodu tętniczego. Przepływ krwi do płuc pochodzi z różnych dysplastycznych (zniekształconych) naczyń krwionośnych z aorta piersiowa , zwana głównymi aortalno-płucnymi tętnicami pobocznymi , te naczynia krwionośne zwężają się w miarę upływu czasu.
Powoduje
Chociaż ta wada wrodzona jest wrodzona, dokładna przyczyna nie jest znana i może się różnić w zależności od dziecka dotkniętego tą chorobą, wiadomo, że następujące czynniki wpływają na ryzyko urodzenia dziecka z tą chorobą:
Genetyka
Genetyka molekularna tego schorzenia nie jest znana u większości osób z PA (VSD), jednakże stwierdzono, że geny kandydujące mogą być powiązane z patogenezą tego schorzenia:
W literaturze medycznej opisano również warianty liczby kopii powiązane z PA (VSD):
- Delecja w chromosomie 16p11.2
- Delecja w chromosomie 5q35.3
- Delecja w chromosomie 5p13.1
- Delecja w chromosomie 22q11.2
- Delecja w chromosomie 15q11.2
- Delecja w chromosomie 8p23.2
- Delecja w chromosomie 17p13.2
- Duplikacja w chromosomie 5q14.1
- Duplikacja w chromosomie 10p13
Badanie przeprowadzone w 1998 roku w Wielkiej Brytanii wykazało, że u dzieci matek z wrodzoną wadą serca (w tym PAVSD) ryzyko urodzenia się z wrodzoną wadą serca jest wyższe w porównaniu z dziećmi, których ojciec miał wrodzoną wadę serca.
Syndromy
Niektóre przypadki PA(VSD) powiązano z zespołami genetycznymi, takimi jak zespół VACTERL , zespół Alagille’a , zespół CHARGE , trisomia 13 , 18 i 21 .
Środowiskowy
Chociaż wrodzonych wad serca nie można nabyć, mogą one być również spowodowane czynnikami środowiskowymi, na które matka narażała się przed ciążą i/lub w jej trakcie, takimi jak:
- Palenie
- Niektóre leki (np. talidomid , retinoidy lub witaminy A )
- Spożycie alkoholu
- Elementy układu wydechowego pojazdu
- Produkty uboczne środków dezynfekcyjnych
- Spalarnie (bliskość)
- Pestycydy rolnicze
- Rozpuszczalniki
- Składowiska śmieci
- Metale ciężkie
Wiadomo, że narażenie matki na tlenek węgla z dymu (np. z papierosów) powoduje szybkie przenikanie przez łożysko do płodu, który następnie przyłącza się do hemoglobiny płodowej, powodując w rezultacie niedobór składników odżywczych i tlenu. W 3 ostatnich metaanalizach wykazano związek między tymi zdarzeniami a wrodzoną wadą serca (w tym PAVSD).
Wykazano również, że palenie przez ojca (tzn. palenie przez ojca) jest czynnikiem przyczyniającym się do wrodzonej choroby serca; podczas gdy lekkie palenie nieznacznie zwiększało ryzyko wystąpienia (wrodzonej) wady serca u potomstwa mężczyzny, intensywne palenie ponad 14 papierosów dziennie podwoiło ryzyko urodzenia dziecka z wrodzoną wadą serca u tego mężczyzny. Większe ilości powiązano z większym ryzykiem urodzenia dzieci z ubytkami w przegrodzie i/lub niedrożnością drogi odpływu lewej komory.
Inne czynniki ryzyka obejmują otyłość matki , cukrzycę , różyczkę, tokolizę indometacyną, fenyloketonurię lub podeszły wiek.
Wieloczynnikowy: obejmujący jednocześnie czynniki genetyczne i środowiskowe
Wykazano, że związek między niektórymi genami a paleniem tytoniu przez matkę zwiększa ryzyko urodzenia dziecka z wrodzoną wadą serca (w tym PAVSD): u matek z genotypem CC w pozycji 677 genu MTHFR istnieje zwiększone ryzyko wystąpienia choroby wieńcowej dziecko. Inne geny zwiększające ryzyko wystąpienia choroby wieńcowej u dziecka palącego matki, u której występują zmiany genetyczne, obejmują ERCC1 , ERCC5 , PARP2 i OSGEP .
Diagnoza
Istnieją różne sposoby diagnozowania tej wrodzonej wady serca, zarówno w okresie prenatalnym, jak i poporodowym. Metody te obejmują:
- Ultradźwięk
- Pulsoksymetria
- Rentgen klatki piersiowej
- Echokardiogram
- Elektrokardiogram
- Cewnikowanie serca
- Tomografia komputerowa serca
- Badania genetyczne (szczególnie w przypadku innych ogólnoustrojowych wad wrodzonych, atrezji płuc i ubytku przegrody międzykomorowej).
Kierownictwo
Po wykryciu zaburzenia (zwykle przed urodzeniem lub wkrótce po porodzie) jak najszybciej zostanie tymczasowo zastosowana prostaglandyna, aby utrzymać przewód tętniczy otwarty tak długo, jak to możliwe, do czasu przeprowadzenia operacji. Ma to na celu umożliwienie dalszego przepływu krwi do płuca, ponieważ ciała dzieci z zarośnięciem płuc zwykle wykorzystują przewód tętniczy do przepływu krwi w płucach w okresie prenatalnym aż do porodu, po czym przewód ten się zamyka.
Następnie tę anomalię zwykle leczy się za pomocą operacji mających na celu poprawę przepływu krwi i funkcji serca, chociaż rodzaj leczenia zależy od struktury układu krążeniowo-oddechowego.
Metody chirurgiczne, które można zastosować w leczeniu (długoterminowego) tego schorzenia obejmują:
- Procedura cewnikowania gałęzi tętnicy płucnej
- Przeciek tętniczy układowo-płucny
- Kompletna naprawa noworodkowa
- Kompleksowa naprawa jednoetapowa
- Septostomia balonowa
- Etapowa unifokalizacja
Częstotliwość
Szacunki dotyczące częstości różnią się w zależności od populacji, szacunki wahają się od 0,01% do 0,2% żywych urodzeń z PAVSD. Uważa się, że stanowi ona 1-2% przypadków wrodzonych wad serca na całym świecie.
Spośród wszystkich pacjentów z PAVSD około 25–32% ma mikrodelecję chromosomu 22q11.2.
Rokowanie
Bez leczenia jest to stan bardzo zagrażający życiu, dlatego rokowanie jest złe. Jeśli w ciężkich przypadkach operacja nie zostanie przeprowadzona, dziecko może (i umrze), ponieważ fenotyp atrezji płuc nie pozwala na życie ze względu na atrezję zastawki płucnej, co powoduje zmniejszone utlenowanie krwi.
Oczekiwana długość życia nieleczonych dzieci z PAVSD wynosi 10 lat. Donoszono, że współczynnik przeżycia nieleczonych osób z tą wadą wynosi 50% w dziesiątej dekadzie i 10% w dwudziestej dekadzie, a spośród tych nieleczonych pacjentów ci, którzy nie mają głównych tętnic aortalno-płucnych, mają większe szanse na przeżycie. 30. niż ci, którzy je mają, ponieważ ci drudzy mają 40% szans na dożycie dziesiątej dekady i 20% szans na dożycie trzydziestej dekady.
Rokowanie po interwencji chirurgicznej jest na ogół dobre.
Historia
To połączenie wad wrodzonych zostało po raz pierwszy opisane w 1980 roku przez DiChiarę i wsp., ich pacjentami byli ojciec i jego syn ze Stanów Zjednoczonych, obaj z atrezją płuc i ubytkiem w przegrodzie międzykomorowej. Do tego momentu nie było rodzinnych przypadków PA z VSD. Podejrzewano u tych pacjentów etiologię wieloczynnikową (tj. przyczynę związaną z genetyką i środowiskiem) i zaoferowano im poradę lekarską w związku z tą chorobą.
Według stanu na rok 2011 najstarszą pacjentką z nieleczonym PAVSD była 59-letnia kobieta z Japonii. Jej schorzenie wykryto w dzieciństwie, ale odmówiła poddania się jakiejkolwiek operacji (w tym cewnikowaniu serca), a duszność rozwinęła się u niej jako nastolatka. Badania radiologiczne wykazały ubytek przegrody międzykomorowej oraz nieprawidłowości serca i tętnic (powiększenie sylwetki serca, uniesienie wierzchołka serca, obecność prawego łuku aorty, powiększenie głównych tętnic płucnych i ich głównych odgałęzień, wysokie unaczynienie tętnic płucnych, ubytek przegrody międzykomorowej) ).