Enterobacteriaceae oporne na karbapenemy
Enterobacteriaceae oporne na karbapenemy ( CRE ) lub Enterobacteriaceae wytwarzające karbapenemazy ( CPE ) to bakterie Gram-ujemne , które są oporne na antybiotyki z grupy karbapenemów , uważane za leki ostatniej szansy na takie infekcje. Są oporne, ponieważ wytwarzają enzym zwany karbapenemazą , który unieszkodliwia cząsteczkę leku. Odporność może wahać się od umiarkowanej do ciężkiej. Enterobacteriaceae są powszechnymi komensalami i czynnikami zakaźnymi. Eksperci obawiają się CRE jako nowego „ superbakterii ”. Bakterie mogą zabić nawet połowę pacjentów z infekcjami krwi . Tom Frieden , były szef Centrum Kontroli i Prewencji Chorób, nazwał CRE „koszmarnymi bakteriami”. Przykładami enzymów występujących w niektórych typach CRE są KPC ( karbapenemaza Klebsiella pneumoniae ) i NDM (metallo-beta-laktamaza z New Delhi). KPC i NDM to enzymy, które rozkładają karbapenemy i czynią je nieskutecznymi. Oba te enzymy, jak również enzym VIM (Verona Integron-Mediated Metallo-β-lactamaze) zostały również opisane w Pseudomonas .
Definicja
Enterobacteriaceae oporne na karbapenemy (CRE) zostały zdefiniowane jako niewrażliwe na karbapenemy i oporne na cefalosporyny o rozszerzonym spektrum działania Escherichia coli , Enterobacter aerogenes , Enterobacter cloacae complex, Klebsiella pneumoniae lub Klebsiella oxytoca . Niektórzy wykluczają z definicji oporność na ertapenem.
Czynniki ryzyka
Szpitale są głównymi miejscami przenoszenia infekcji opartych na CRE. Aż 75% przyjęć do szpitali przypisywanych CRE pochodziło z placówek opieki długoterminowej lub zostało przeniesionych z innego szpitala. Nieoptymalne praktyki konserwacyjne są największą przyczyną transmisji CRE. Obejmuje to brak odpowiedniego czyszczenia i dezynfekcji szafek na leki, innych powierzchni w salach pacjentów oraz przenośnego sprzętu medycznego, takiego jak aparaty rentgenowskie i ultrasonograficzne, które są używane zarówno u pacjentów z CRE, jak i bez CRE. Do tej pory CRE były głównie szpitalnymi czynnikami zakaźnymi. Prawie wszystkie infekcje CRE występują u osób otrzymujących znaczną opiekę medyczną w szpitalach, ośrodkach opieki długoterminowej lub domach opieki. Niezależne czynniki ryzyka zakażenia CRE obejmują stosowanie antybiotyków beta-laktamowych i stosowanie wentylacji mechanicznej . Wykazano również, że pacjenci z cukrzycą są narażeni na podwyższone ryzyko nabycia infekcji CRE. W porównaniu z innymi hospitalizowanymi pacjentami, osoby przyjmowane z placówek opieki długoterminowej (LTAC) mają znacznie wyższą częstość kolonizacji i wskaźników infekcji. Inne wieloośrodkowe badanie z 2012 roku wykazało, że ponad 30% pacjentów z niedawną ekspozycją na LTAC było skolonizowanych lub zakażonych CRE. Osoba podatna na przenoszenie CRE jest częściej płci żeńskiej, ma większą liczbę żywienia pozajelitowego (czyli dni, w których osoba otrzymywała odżywianie przez krwiobieg) i miała znaczną liczbę dni oddychania przez respirator. Zakażenia Klebsiella pneumoniae opornymi na karbapenemy były związane z przeszczepami narządów/komórek macierzystych, wentylacją mechaniczną, narażeniem na środki przeciwdrobnoustrojowe i ogólnie dłuższym pobytem w szpitalu. Osoby, które są najbardziej narażone na nabycie bakterii opornych na karbapenemy, to osoby już otrzymujące pomoc medyczną. W badaniu przeprowadzonym w ośrodku medycznym Sheba zaobserwowano tendencję do gorszych współwystępowania choroby Charlesona u pacjentów, którzy nabyli CRKP podczas pobytu na OIT. Do grupy największego ryzyka należą pacjenci otrzymujący implantację narządu lub komórek macierzystych, stosujący wentylację mechaniczną lub wymagający dłuższego pobytu w szpitalu wraz z ekspozycją na środki przeciwdrobnoustrojowe. Badanie przeprowadzone w Singapurze, dotyczące nabycia opornych na ertapenemy Enterobacteriaceae do nabycia CRE. wykazali, że narażenie na antybiotyki, zwłaszcza fluorochinolony, oraz wcześniejsza hospitalizacja radykalnie zwiększyły ryzyko nabycia bakterii opornych na karbapenemy. Badanie to wykazało, że nabycie oporności na karbapenemy ma znacznie wyższą śmiertelność i gorszą odpowiedź kliniczną w porównaniu z nabyciem oporności na ertapenemy. [ potrzebne źródło ]
Bakteriomocz (znany również jako infekcja dróg moczowych ) wywołany przez CRKp i CSKp ma podobne czynniki ryzyka. Obejmują one wcześniejsze stosowanie antybiotyków, przyjęcie na oddział intensywnej terapii, stosowanie stałego cewnika moczowego oraz wcześniejsze inwazyjne procedury lub operacje. Retrospektywne badanie pacjentów z zakażeniem CRKp i CSKp wykazało, że stosowanie cefalosporyn (klasa antybiotyków β-laktamowych) stosowanych przed zabiegami inwazyjnymi było częstsze u pacjentów z zakażeniem CRKp, co sugeruje, że jest to czynnik ryzyka.
W trzyletnim badaniu wykazano, że częstość występowania CRE jest proporcjonalna do długości pobytu pacjentów w tych szpitalach. Zasady dotyczące środków ostrożności w kontaktach z pacjentami zakażonymi lub skolonizowanymi przez patogeny Gram-ujemne zaobserwowano również w szpitalach zgłaszających spadek częstości występowania CRE.
Jedno studium przypadku wykazało, że pacjenci z upośledzoną odpowiedzią immunologiczną są szczególnie podatni zarówno na ekspozycję na CRE, jak i na infekcję. W jednym badaniu starszy pacjent z ostrą białaczką limfoblastyczną leczony w placówce opieki długoterminowej nabawił się zakażenia CRE. Jej wiek i stan, w połączeniu z jej środowiskiem i regulacją przez cewnik i wentylację mechaniczną, wszystko to przyczyniło się do większej podatności. Podkreśla to znaczenie znalezienia źródła bakterii, ponieważ członkowie tej klasy pacjentów są stale narażeni na infekcję. Kontrola zakażeń i zapobieganie CRE powinny być głównym celem leczenia pacjentów z grupy wysokiego ryzyka. [ potrzebne źródło ]
Innym ważnym czynnikiem ryzyka jest przebywanie w kraju o nieuregulowanej dystrybucji antybiotyków. W krajach, w których antybiotyki są dostępne bez recepty i bez recepty, częstość występowania i rozpowszechnienie zakażeń CRE były wyższe. Jedno z badań przeprowadzonych w Japonii wykazało, że 6,4% zdrowych osób dorosłych było nosicielami szczepów wytwarzających ESBL (głównie cefotaksimazę), w porównaniu z 58,4% w Tajlandii, gdzie antybiotyki są dostępne bez recepty i bez recepty. Egipska grupa badawcza odkryła, że 63,3% zdrowych dorosłych zostało skolonizowanych.
W lutym 2015 r. FDA poinformowała o ryzyku przeniesienia, gdy ludzie przechodzą procedurę gastroenterologiczną zwaną endoskopową cholangiopankreatografią wsteczną , podczas której endoskop wchodzi do ust, przechodzi przez żołądek i kończy się w dwunastnicy ; jeśli urządzenie nie zostanie całkowicie zdezynfekowane, może przenosić CRE od jednego pacjenta do drugiego. Komunikat FDA dotyczący bezpieczeństwa pojawił się dzień po tym, jak UCLA Health System w Los Angeles powiadomił ponad 100 pacjentów, że mogli zostać zarażeni CRE podczas endoskopii w okresie od października 2014 do stycznia 2015. FDA wydała pierwsze zawiadomienie o urządzeniach w 2009 roku .
Przenoszenie przez zwierzęta
Ponieważ rozprzestrzenianie się bakterii CRE ze zwierząt na ludzi może stać się problemem w przyszłości, zaleca się monitorowanie CRE zarówno u zwierząt gospodarskich, jak iu ludzi. [ potrzebne źródło ]
Mechanizm
Funkcja antybiotyku
Rodzina cząsteczek antybiotyków β-laktamowych obejmuje cztery grupy: penicyliny, cefalosporyny, karbapenemy (takie jak imipenem, ertapenem, meropenem i doripenem) oraz monobaktamy.
Te antybiotyki mają wspólną strukturę i mechanizm działania. Dostają się do przestrzeni peryplazmatycznej przez poryny , gdzie następnie hamują transpeptydazy (znane również jako białka wiążące penicylinę (PBP)), enzymy ułatwiające sieciowanie peptydów podczas syntezy ściany komórkowej. Ich wiązanie z miejscem aktywnym PBP jest częściowo ułatwione dzięki ich wspólnej strukturze, która jest podobna do struktury D-alanylo-D-alaniny. D-alanylo-D-alanina jest resztą na podjednostce peptydu NAM zaangażowanej w budowę peptydoglikanu . Karbapenem wiąże się kowalencyjnie z PBP, co powoduje, że transpeptydazy nieodwracalnie tracą swoją aktywność katalityczną. Hamowanie transpeptydaz zapobiega tworzeniu się wiązań poprzecznych między polimerami peptydoglikanu i powoduje gromadzenie się prekursorów peptydoglikanu. Nowo utworzony peptydoglikan jest osłabiony z powodu braku wiązań poprzecznych. Ciągła aktywność autolizyn , które działają jak lizozymy i rozszczepiają wiązania glikozydowe i peptydowe peptydoglikanu w peryplazmie, osłabiają ścianę komórkową i prowadzą do rozerwania osmotycznego komórki bakteryjnej. [ potrzebne źródło ]
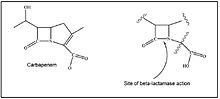
Wyjątkową cechą karbapenemów jest ich odporność na hydrolizę przez bakteryjny plazmid i chromosomalnie pośredniczone β-laktamazy o rozszerzonym spektrum (ESBL).
Oporność na karbapenemy
Ogólnie rzecz biorąc, karbapenem, antybiotyk β-laktamowy , działa na komórki poprzez hamowanie transpeptydaz (białek wiążących penicylinę). Zapobiega to syntezie peptydoglikanu , niezbędnego składnika strukturalnego, prowadzącego do lizy komórek. Oporność na karbapenemy wśród bakterii Gram-ujemnych w ogólności (tj. włączając bakterie inne niż Enterobacteriaceae) może zostać nabyta poprzez kilka mechanizmów.
- U niektórych opornych gatunków obserwowano aktywny transport karbapenemów poza komórkę, zwiększony wypływ leku. [ potrzebne źródło ]
- Jednym z mechanizmów oporności jest mutacja lub utrata poryn błony zewnętrznej , co zapobiega przedostawaniu się antybiotyków do komórek. Zmiany w genie białka poriny powodują przesunięcie ramki odczytu , zmieniając strukturę i funkcję poriny. Zmiany w białku porin utrudniają dyfuzję karbapenemu i innych antybiotyków do peryplazmy. Bakterie, które wykazują ekspresję β-laktamaz przenoszonych przez plazmidy o rozszerzonym spektrum (ESBL), mogą stać się oporne na karbapenemy, jeśli sekwencja insercji lub duplikacja czterech nukleotydów jest obecna w genach chromosomalnych dla białek porin błony zewnętrznej. Klebsiella pneumoniae została powiązana z brakiem białek porin błony zewnętrznej, OmpK35 i OmpK36. Utratę poryn OmpK36 można przypisać mutacjom punktowym, które skutkują przedwczesnym zakończeniem translacji, w wyniku czego powstaje skrócone, aw konsekwencji niefunkcjonalne białko. Te białka błony zewnętrznej biorą udział w przenoszeniu antybakteryjnego materiału genetycznego w komórce. Utrata OmpK35 i OmpK36 lub tylko OmpK36 prowadzi do oporności na karbapenemy. U Klebsiella pneumoniae brak OmpK35 lub OmpK36 prowadzi do oporności na karbapenemy, ale przy braku obu białek występuje wysoki poziom oporności. Zaobserwowany 32- do 64-krotny wzrost minimalnych stężeń hamujących występuje dla karbapenemów, gdy oba białka nie ulegają ekspresji.
- CRE produkują karbapenemazy, formę β-laktamazy. Enzymy te rozszczepiają pierścień β-laktamowy, niezbędny składnik antybiotyków β-laktamowych, które są rozpoznawane przez PBP i wiążą się z nimi. Karbapenemazy dzielą się na różne klasy, w zależności od budowy enzymu i mechanizmu hydrolizy pierścienia β-laktamowego. Dwie szerokie kategorie karbapenemaz to karbopenemazy serynowe, które zawierają serynę w miejscu aktywnym, oraz metalokarbapenemazy, które zawierają cynk w miejscu aktywnym. Karbapenemazy klasy A są karbapenemazami serynowymi i są kodowane na chromosomie bakterii lub plazmidzie. Seryna w pozycji 70 w miejscu aktywnym tej klasy enzymów jest wymagana do zajścia hydrolizy β-laktamów. Karbapenemazy klasy D, określane również jako β-laktamazy OXA, to β-laktamazy serynowe. Są one zakodowane na plazmidach i charakteryzują się dużą zmiennością sekwencji aminokwasów. Mechanizm oporności na karbapenemazy klasy D jest spowodowany tworzeniem acylowego związku pośredniego podczas rozrywania pierścienia β-laktamowego. Karbapenemazy klasy B są metalololaktamazami i do hydrolizy wymagają cynku w miejscu aktywnym.
- że kliniczny izolat E. coli z próbki plwociny pacjenta przyjętego do szpitala w Pekinie nabył oporność na karbapenem w wyniku wcześniej nieobserwowanych mutacji. Obejmował on mutację genu regulatorowego marR i ekspresję normalnie nieprzechodzącej translacji błonowej porin yedS; wykazano, że obie mutacje mają wpływ na zdolność tego szczepu E. coli do oporności na karbapenemy. Szczep nie posiadał białek błony zewnętrznej OmpF i OmpC i wykazywał zwiększoną ekspresję wielolekowej pompy wypływowej , ale nie wytwarzał karbapenemazy.
CR Pseudomonas aeruginosa jest powszechnie obecna na oddziałach intensywnej terapii i może prowadzić do niebezpiecznych infekcji. W tajlandzkich szpitalach spośród 261 wielolekoopornych próbek P. aeruginosa (nienależących do Enterobacteriaceae) pobranych z P. aeruginosa), 71,65% było opornych na karbapenemy.
Transfer między bakteriami
Bakterie Gram-ujemne mogą rozwijać i przenosić oporność na β-laktamy (w tym oporność na karbapenemy) na wiele sposobów. Mogą generować nowe β-laktamazy o rozszerzonym spektrum (ESBL) z istniejącego spektrum β-laktamaz, w których pośredniczą plazmidy, poprzez substytucję aminokwasów. Mogą nabywać geny kodujące ESBL z bakterii środowiskowych. Mogą zwiększać ekspresję genów β-laktamaz kodowanych w chromosomach ( bla ) dzięki modyfikacjom genu regulatorowego i sekwencji promotora. Mogą mobilizować bla poprzez integrony lub poziomy transfer wysp genomowych do innych gatunków i szczepów Gram-ujemnych. Mogą rozprzestrzeniać karbapenemazy, w których pośredniczą plazmidy. Wreszcie mogą obniżać lub nawet hamować ekspresję genów porin.
Trzy główne klasy enzymów biorą udział w oporności na karbapenemy: karbapenemazy klasy A, metalo-β-laktamazy klasy B (MBL) i β-laktamazy klasy D (OXA). Cztery znane grupy karbapenemaz klasy A to: SME (trzy typy związane z S. marcescens ), IMI (obecne w E. cloacae ), GES (16 wariantów znalezionych dotychczas głównie w P. aeruginosa , ale również w K. pneumoniae i E. coli ) i KPC (10 rodzajów karbapenemazy K. pneumoniae ). W Centrum Medycznym UVA odkryto mechanizm przenoszenia oporności na karbapenemy zależne od KPC w transmisji plazmidu niosącego transpozon (Tn4401), który zawiera gen KPC (bla KPC), do kilku bakterii, w tym Enterobacter cloacae , Klebsiella oxytoca , E. coli i Citrobacter freundii . Metalo-β-laktamazy klasy B (MBL) występują głównie w bakteriach Gram-ujemnych i bakteriach środowiskowych. Podklasy enzymów MBL to B1, B2 i B3. MBL mają różnorodne funkcje enzymatyczne i mają zdolność hydrolizy antybiotyków β-laktamowych. β-laktamazy klasy D (OXA), które hydrolizują oksacylinę, stanowią dobry przykład różnorodności mechanizmów, które można wykorzystać do przenoszenia oporności. Geny bla OXA , które kodują β-laktamazy OXA, znajdują się zarówno na chromosomach, jak i plazmidach, a ich naturalnym rezerwuarem są bakterie środowiskowe i mikroflora głębinowa. Wykazano, że insercje w pobliżu tych genów zwiększają siłę ich promotorów i zwiększają odporność. Ze względu na te cechy, w szczególności nastąpiło szerokie geograficzne rozpowszechnienie oporności na karbapenemazy OXA.
Wydaje się, że ułatwione rozprzestrzenianie się oporności na karbapenemy ma wiele źródeł i wielokrotne wprowadzanie do Wielkiej Brytanii bakterii z genem bla OXA-48 poprzez poziomy transfer podobnych plazmidów do pOXA-48a. Niedawne badanie przeprowadzone w Wielkiej Brytanii zbadało 26 izolatów Enterobacteriaceae składających się z różnych zestawów typów sekwencji (ST) K. pneumoniae , E. coli i Enterobacter cloacae wytwarzających karbapenemazy podobne do OXA-48. [ potrzebne źródło ] Ich odkrycia obejmowały:
- 25 z 26 szczepów miało gen bla OXA-48 .
- 21 z tych izolatów miało plazmidy oporności, które można było przenosić przez koniugację; 20 z tych transformantów miało trzy funkcjonalne geny, repA , traU i parA znalezione w pOXA-48a. [ potrzebne źródło ]
- W ST38 E. coli nie znaleziono transkoniugantów OXA-48 i miał on tylko gen parA . [ potrzebne źródło ]
- Indyjski szczep K. pneumonia miał plazmid kodujący OXA-181 (który miał wyższą oporność na karbapenemy), a także nie mógł być przenoszony przez koniugację i nie miał żadnego z trzech funkcjonalnych genów znalezionych w pOXA-48a.
Bakterie Gram-ujemne
Pęcherzyki błony zewnętrznej (OMV), które mogą przenosić DNA między komórkami bakteryjnymi, są wytwarzane przez aktywne metabolicznie komórki bakteryjne, a OMV nie są wynikiem lizy lub śmierci komórki. Szczepy chorobotwórcze mogą wytwarzać około 10-25 razy więcej pęcherzyków niż szczep niepatogenny, co ma duże znaczenie dla przenoszenia oporności na karbapenemy. OMV chronią plazmidy przed trawieniem zewnątrzkomórkowym przez nukleazy, które można znaleźć w środowisku, sprzyjając w ten sposób poziomemu transferowi genów .
Analiza laboratoryjna
Metoda płytek agarowych
Widoczne są różnice w pożywkach stosowanych do inokulacji. W wielu badaniach stosuje się pożywki zawierające od 1 do 2 mg/l imipenemu. Jednak bakterie wytwarzające OXA-48 lub OXA-181 powodują oporność na niskim poziomie, której nie można skutecznie wykryć ze względu na wysokie stężenie. Dlatego nowsze podłoża przesiewowe wykorzystują bulion zawierający 0,5–1 mg/l imipenemu lub 0,5 mg/l ertapenemu . Wadami tego podejścia są opóźnienia w uzyskaniu wyników posiewu oraz brak możliwości identyfikacji typu karbapenemazy. [ potrzebne źródło ]
Metoda dyfuzji dyskowej
Metoda dyfuzji krążkowej może być stosowana przez laboratoria szpitalne do badań przesiewowych w kierunku CRE. W tej technice krążki z antybiotykiem umieszcza się na płytkach z agarem Mueller Hinton, które zostały już zaszczepione szczepem próbki. Płytki następnie inkubuje się przez noc w temperaturze 37°C. Po inkubacji mierzone są strefy zahamowania otaczające różne krążki z antybiotykami i porównywane z wytycznymi Clinical and Laboratory Standard Institute. Identyfikację KPC, MBL i OXA można osiągnąć poprzez wykazanie synergistycznego hamowania odpowiednio z kwasem fenyloborowym, EDTA lub żadnym z nich.
W przeprowadzonym w Tajlandii badaniu CRE w warunkach szpitalnych oporność na karbapenemy zdefiniowano jako każdy szczep wykazujący oporność na co najmniej jeden z trzech badanych antybiotyków z grupy karbapenemów.
metoda PCR
Metodologie badań przesiewowych oparte na PCR są w trakcie opracowywania dla szeregu genów odpowiedzialnych za oporność. Przyspieszają wykrywanie i mogą łatwo różnicować geny karbapenamazy - czasami w formacie multipleksowym. Koszty testów PCR maleją, a wiarygodność testów molekularnych odnosi się bardziej do obecności genów i ekspresji genów do produkcji odpowiedniej karbapenamazy. Zagnieżdżony arbitralny PCR (ARB-PCR) został użyty podczas wybuchu epidemii CRE w 2007 roku w University of Virginia Medical Center w celu zidentyfikowania konkretnego bla KPC zaangażowanego w przenoszenie infekcji, a naukowcy sugerują, że ARB-PCR może być również używany do identyfikacji inne metody rozprzestrzeniania CRE.
MALDI TOF MS
W innym badaniu wykorzystano spektrometrię mas z desorpcją laserową wspomaganą matrycą i spektrometrię masową czasu przelotu (MALDI-TOF MS) w celu określenia wzorców oporności u bakterii ze świeżo dodatnich posiewów krwi. [ potrzebne źródło ] MALDI-TOF MS może wykrywać zmiany w stosunkach masy do ładunku. Bakterie oporne na kabapenemy często wykorzystują β-laktamazy, które fizycznie niszczą strukturę antybiotyków β-laktamowych. Ponieważ powoduje to zmianę masy antybiotyku, oporne bakterie są wykrywalne za pomocą MALDI-TOF MS. Akceptowane testy kliniczne często wymagają całonocnej inkubacji przed odczytaniem wyniku, ale MALDI-TOF MS może zwrócić wyniki w ciągu zaledwie 4–5 godzin. [ potrzebne źródło ]
MALDI-TOF nie jest w stanie wykryć bakterii opornych, które fizycznie nie niszczą antybiotyku β-laktamowego, tj. w przypadku braku zmiany masy. Dlatego metoda ta najlepiej sprawdza się jako pierwszy test przesiewowy u pacjentów przyjmowanych do szpitala, ale powinna być poprzedzona badaniami wtórnymi.
Zapobieganie
Naukowcy odkryli środowiskowe rezerwuary bakterii CRE w zlewach i odpływach OIOM. Pomimo wielokrotnych prób sterylizacji tych zlewów i odpływów przy użyciu detergentów i pary, personelowi szpitala nie udało się pozbyć CRE. Ze względu na oporność bakterii na środki czyszczące, personel powinien zachować szczególną ostrożność w utrzymywaniu sterylnego środowiska w szpitalach, które nie zostały jeszcze zakażone bakteriami opornymi na CRE.
Głównym sposobem przenoszenia jest zlewozmywak, dlatego personel powinien zachować dodatkowe środki ostrożności w utrzymywaniu sterylnych warunków. Szpitale mogłyby ograniczyć transmisję, tworząc zlewozmywaki o konstrukcjach, które mogłyby zmniejszyć backsplash. Inną metodą ograniczenia transmisji ze zlewu do zlewu jest posiadanie szczotek do zlewu w każdym pokoju, które byłyby przeznaczone do czyszczenia tylko tego zlewu. Personel szpitalny powinien zostać przeszkolony, aby nigdy nie wyrzucać odpadów medycznych do zlewów w salach pacjentów. Szpital w Melbourne w Australii wdrożył podobne strategie, aby ograniczyć transmisję i zapobiec dalszym infekcjom większej liczby pacjentów OIOM. Uzbrojone w wiedzę o swoim statusie miejsc transmisji CRE, szpitale muszą zachować szczególną ostrożność, aby monitorować ogniska CRE na swoich oddziałach. Skuteczne i dokładne wykrywanie CRE to pierwszy krok. Enterobacteriaceae są najczęściej spotykane we florze jelitowej. Stosowanie wymazów ze stolca i odbytu jest zatem najbardziej wiarygodną metodą badania oporności.
Brak kodu rozliczeniowego dla CRE w ramach Medicare lub Medicaid , co utrudnia śledzenie na poziomie krajowym w USA. Kolejnym wyzwaniem stojącym przed wysiłkami na rzecz kontroli transmisji jest fakt, że chociaż placówki opieki długoterminowej są często wskazywane jako główne ośrodki zachorowań , amplifikacji i rozprzestrzeniania się CRE, badania, które kontrolowały tę transmisję, nadal wykazały rozprzestrzenianie się CRE w innych stowarzyszonych szpitalach, co wskazuje, że długoterminowe placówki opieki doraźnej prawdopodobnie nie są jedynym winowajcą rozprzestrzeniania się CRE i innych wielolekoopornych organizmy.
Jedną ze skutecznych metod jest sprawdzanie i izolowanie pacjentów przychodzących z innych placówek oraz ponowne skupienie się na myciu rąk . Nie są opracowywane żadne nowe leki dla bakterii, a szybka adaptacja bakterii do nowych leków sprawia, że inwestycja w ich rozwój jest nieopłacalna, ponieważ nowy lek szybko stałby się bezużyteczny. Badania wykazały, że częstość występowania i rozpowszechnienie CRE można zmniejszyć, stosując ukierunkowane interwencje, w tym zwiększone środki higieny i sterylizację sprzętu, nawet w populacjach, w których częstość występowania infekcji przekracza 50% pacjentów. Jednak dodatkowe oczyszczanie środowiska w celu kontrolowania transmisji nie zostało zweryfikowane w kontrolowanych próbach. Zaangażowanie lokalnych i krajowych organów ds. zdrowia publicznego będzie prawdopodobnie miało kluczowe znaczenie dla zapewnienia szerszego i bardziej zrównoważonego wdrożenia tych środków. [ potrzebne źródło ]
Zapobieganie jest najwyższym priorytetem w ograniczaniu przenoszenia CRE z osoby na osobę. Jest to szczególnie prawdziwe, ponieważ dostępne są ograniczone możliwości leczenia po rozwinięciu się oporności na karbapenemy. Większość aktualnych badań wymaga skoordynowanego, wielopłaszczyznowego podejścia do zapobiegania i powstrzymywania infekcji, a Centra Kontroli i Zapobiegania Chorobom wydały wstępne wytyczne dotyczące kontroli transmisji CRE. Eksperci opowiadają się za podejściem proaktywnym, opartym na przekonaniu, że najbardziej opłacalne będzie zwalczanie problemu, zanim się on rozwinie. Jednakże, gdy bezpośrednie zasoby finansowe i kadrowe są ograniczone, administratorzy opieki zdrowotnej mogą być zmuszeni do reagowania, mającego na celu ograniczenie dalszej transmisji.
Chociaż istnieje konsensus co do potrzeby protokołów zapobiegawczych, praktyki kontroli zakażeń często różnią się między szpitalami, nawet w obrębie bliskiego obszaru geograficznego. W ankiecie przeprowadzonej wśród 15 szpitali w rejonie Toronto wiele szpitali stosowało różne kombinacje podstawowych praktyk kontroli zakażeń. W 15 szpitalach zaobserwowano osiem różnych praktyk, z których niektóre uwzględniono w najnowszej publikacji wytycznych Kanadyjskiej Agencji Zdrowia Publicznego . Niektóre z tych zaleceń obejmują badania laboratoryjne, aktywny nadzór, badania przesiewowe (wymaz z odbytu, posiew moczu), higienę rąk, środki ochrony indywidualnej , sprzątanie środowiska, gospodarowanie odpadami z prania oraz izolację przy użyciu specjalnego sprzętu i personelu pielęgniarskiego. Jednak tylko pięć szpitali miało spisane zasady opisujące sposób reagowania na wybuch epidemii. Wiele inicjatyw w zakresie zdrowia publicznego zmierza w kierunku bardziej ustandaryzowanego podejścia na wielu poziomach: wśród lokalnych placówek (zwłaszcza opieki długoterminowej i doraźnej), szpitali regionalnych, instytucji krajowych i praktyk globalnych. [ potrzebne źródło ] Standaryzowane podejście do profilaktyki może pomóc w skuteczniejszym ograniczaniu występowania CRE. [ potrzebne źródło ]
W Kaplan Medical Center w Izraelu wdrożono plan kontroli zakażeń w celu opanowania szpitalnej epidemii K. pneumoniae opornej na karbapenemy. Kompleksowy plan obejmował wytyczne dotyczące kohortowania pacjentów w oddzielnych lokalizacjach, czyszczenia podchlorynem o stężeniu 1000 ppm , badań przesiewowych w kierunku izolatów z wymazów z odbytu oraz dystrybucji arkuszy instrukcji edukacyjnych, wykładów dla całego personelu medycznego i szkoleń. Szpital wdrożył również zautomatyzowany system komputerowy, który aktualizował karty pacjentów, gdy zgłaszano nowe przypadki, czy pacjenci byli nosicielami i jakie środki ostrożności należy podjąć w kontaktach z takimi pacjentami. Plan ten został oceniony w badaniu quasi-eksperymentalnym na podstawie częstości występowania przypadków klinicznych, wskaźnika zakażeń krzyżowych oraz wskaźnika badań przesiewowych pod kątem nosicielstwa u przyjętych pacjentów ze zwiększonym ryzykiem nosicielstwa. Badanie wykazało 16-krotny spadek częstości występowania opornych K. pneumoniae , który utrzymywał się przez 30 miesięcy. Plan może stanowić model dla innych szpitali w zakresie powstrzymywania wybuchów bakterii opornych na karbapenemy. Zmniejszenie użycia niepotrzebnych urządzeń inwazyjnych, w tym cewników moczowych, może pomóc w ograniczeniu transmisji CRE.
Kilka metod zostało przetestowanych pod kątem ich skuteczności w poprawie dokładnej higieny środowiska na oddziale intensywnej terapii. Badanie przeprowadzone w 2010 roku na 3532 powierzchniach środowiskowych wysokiego ryzyka w 260 salach oddziałów intensywnej terapii w 27 szpitalach intensywnej terapii (OIOM) oceniło spójność, z jaką te powierzchnie spełniały podstawowe standardy czystości. Stwierdzono, że tylko 49,5% powierzchni obiektów wysokiego ryzyka spełnia to podstawowe kryterium. Najrzadziej czyszczonymi przedmiotami były włączniki światła w łazience, klamki do drzwi pokojowych i środki do czyszczenia basenów. Znaczącą poprawę w zakresie sprzątania sal OIOM osiągnięto dzięki ustrukturyzowanemu podejściu, które obejmowało prostą, wysoce obiektywną metodę celowania w powierzchnię oraz wielokrotne informacje zwrotne dotyczące wydajności dla personelu zajmującego się powierzchnią środowiskową. Konkretne metody obejmowały wdrożenie procesu obiektywnej oceny, edukację personelu w zakresie powierzchni środowiskowych, programowe informacje zwrotne i ciągłe szkolenia w celu zminimalizowania rozprzestrzeniania się zakażeń szpitalnych. Autorzy odnotowali poprawę dokładności sprzątania na poziomie 71% od wartości wyjściowej dla całej grupy szpitali biorących udział w badaniu.
Zabiegi
Fosfomycyna
Przetestowano kilka leków przeciwdrobnoustrojowych pod kątem skutecznego leczenia CRE. Fosfomycyna jest środkiem przeciwbakteryjnym, który hamuje transferazę enolopirogronianową UDP-N-acetyloglukozaminy (MurA), która katalizuje jeden z wczesnych etapów syntezy ściany komórkowej bakterii i jest skuteczny przeciwko bakteriom tlenowym Gram-ujemnym i dodatnim, takim jak CRE. Metaanaliza 17 badań oceniających skuteczność kliniczną fosfomycyny w czterech wielolekoopornych szczepach Enterobacteriaceae wykazała 11, w których stwierdzono, że ponad 90% izolatów bakteryjnych było wrażliwych na fosfomycynę. [ potrzebne źródło ]
Podwyższony poziom aktywności przeciwbakteryjnej fosfomycyny można przypisać faktowi, że oporność na ten antybiotyk u Enterobacteriaceae jest kodowana chromosomalnie, a nie za pośrednictwem plazmidu. Powoduje to zmniejszenie zdolności przeżycia bakterii. Bakterie, które są naturalnie oporne na fosfomycynę, są mniej odporne i mniej chorobotwórcze.
Tygecyklina
Tygecyklina , należąca do grupy antybiotyków glicylocyklinowych, okazała się skuteczną terapią przeciwko Enterobacteriaceae, które zazwyczaj wykazują oporność na tetracyklinę , ponieważ tygecyklina ma większe powinowactwo wiązania z miejscami rybosomalnymi niż tetracyklina. [ potrzebne źródło ] Tygecyklina jest zdolna do zabijania prawie wszystkich ESBL i wielolekoopornych (MDR) izolatów E. coli oraz znacznej większości izolatów ESBL i MDR gatunków Klebsiella . [ potrzebne źródło ]
Przegląd 42 badań wrażliwości bakterii in vitro na tygecyklinę z 2008 roku wykazał, że MDR K. pneumoniae i E. coli , w tym te, które były oporne na karbapenemy, były wrażliwe w ponad 90% przypadków. Ograniczona liczba pacjentów była leczona tygecykliną, ale FDA zatwierdziła ją w niektórych przypadkach z synergią innych leków. Ograniczona liczba pacjentów wskazuje, że potrzeba więcej badań, aby określić ogólną skuteczność kliniczną.
Chociaż tygecyklina jest jedną z pierwszych linii obrony przed izolatami wytwarzającymi karbapenemazy, wystąpiły negatywne wyniki kliniczne z tygecykliną. Zarówno infekcje dróg moczowych, jak i pierwotne zakażenia krwi mogą sprawić, że tygecyklina będzie nieskuteczna, ponieważ ma odpowiednio ograniczoną penetrację i szybką dyfuzję tkankową po podaniu dożylnym.
Inne antybiotyki
Alternatywy dla fosfomycyny obejmują nitrofurantoinę , piwmeklinam i koamoksyklaw w doustnym leczeniu infekcji dróg moczowych związanych z beta-laktamazą o rozszerzonym spektrum działania.
W oddzielnym badaniu CRE leczono kolistyną , amikacyną i tygecykliną i podkreśla się znaczenie stosowania gentamycyny u pacjentów poddawanych chemioterapii lub procedurom terapii komórkami macierzystymi. Podczas gdy kolistyna wykazała obiecującą aktywność przeciwko izolatom wytwarzającym karbapenemazy, nowsze dane sugerują, że pojawia się już oporność na nią i wkrótce stanie się ona nieskuteczna.
Jednoczesne stosowanie innego antybiotyku z karbapenemem może pomóc w zapobieganiu rozwoju oporności na karbapenemy. Jedno konkretne badanie wykazało wyższy wskaźnik oporności na karbapenemy przy stosowaniu samego meropenemu w porównaniu z terapią skojarzoną z moksyfloksacyną.
Ponadto przetestowano kilka leków, aby ocenić ich skuteczność przeciwko infekcjom CRE. Badania in vitro wykazały, że ryfampicyna ma działanie synergistyczne wobec opornych na karbapenemy E. coli i K. pneumoniae . Jednak potrzeba więcej danych, aby określić, czy ryfampicyna jest skuteczna w warunkach klinicznych.
Kilka nowych agentów jest w fazie rozwoju. Głównymi obszarami, na których koncentrują się naukowcy, są nowe inhibitory β-laktamazy o aktywności przeciwko karbapenemazom. Niektóre z nich obejmują sulfony MK-7655, NXL104 i 6-alkilidenepenamu. Dokładny sposób, w jaki wpływają na karbapenemazy, jest nieznany. Innym eksperymentalnym środkiem o aktywności przeciwko CRE jest erawacyklina .
Epidemiologia
Przed 1992 rokiem CRE były stosunkowo rzadkie w Stanach Zjednoczonych. Według danych National Nosocomial Infection Service, w latach 1986-1990 tylko 2,3% z 1825 izolatów Enterobacteriaceae, z których pobrano próbki, było opornych.
Według amerykańskich Centrów Kontroli Chorób, CRE wytwarzające najpowszechniejszy rodzaj enzymu niszczącego karbapenemy w 2001 roku zostały po raz pierwszy wykryte w szpitalu w Północnej Karolinie w 1996 roku. Od tego czasu zostały zidentyfikowane w placówkach opieki zdrowotnej w 41 innych stanach . W 2012 r. 3% pacjentów przebywających na oddziałach intensywnej terapii w Chicago było nosicielami CRE. Te same dane [ które? ] wskazują na 30% wskaźnik kolonizacji w placówkach opieki długoterminowej (np. domach opieki), gdzie pacjenci nie wykazują objawów . Tylko w pierwszej połowie 2012 r. prawie 200 szpitali i placówek opieki długoterminowej leczyło co najmniej jednego pacjenta zakażonego tymi bakteriami.
CRE stają się coraz bardziej powszechne w Stanach Zjednoczonych. W ramach rocznego programu gromadzenia informacji o testach wrażliwości na Meropenem odnotowano, że oporność K. pneumoniae wzrosła z 0,6% w 2004 r. do 5,6% w 2008 r. Odkryto pierwszy wybuch epidemii z udziałem K. pneumoniae opornego na kolistynę i karbapenemy (CRKP) w USA w Detroit w stanie Michigan w 2009 roku, z udziałem trzech różnych instytucji opieki zdrowotnej. W aktywnym badaniu obserwacyjnym w siedmiu stanach USA w ciągu dwóch lat surowa ogólna częstość występowania CRE wyniosła 2,93 na 100 000 populacji. Georgia i Maryland miały znacznie wyższą niż przewidywano częstość występowania, skorygowaną o wiek i rasę.
Wzrosty CRE nie ograniczają się do Stanów Zjednoczonych. Do 2011 roku CRE odnotowano w co najmniej 22 krajach. W latach 2009-2012 udokumentowano 10 przypadków zakażeń CRE u pacjentów OIT w szpitalu w Melbourne w Australii.
Niektóre przypadki CRE są związane z otrzymaniem opieki medycznej w USA. Szczepy znalezione w Izraelu miały genetyczne podobieństwo do szczepów z USA. Stwierdzono, że szpitalne stacje mycia rąk są rezerwuarami środowiskowymi dla CRE po sprawdzeniu wszystkich miejsc mokrych, w tym zlewów, fontann i maszyn do lodu. Głównymi rezerwuarami CRE były zlewy na OIOM-ie, a niewłaściwe metody czyszczenia stanowiły przyczynę przenoszenia się z jednego zlewu do zlewu. Według analizy genetycznej szczepy CRE w umywalkach i szczepy infekujące pacjentów OIOM były identyczne. Pacjenci z grupy ryzyka byli zakażani w warunkach szpitalnych.
Śmiertelność
Oporność na CRE zależy od wielu czynników, takich jak stan zdrowia pacjenta, to, czy pacjent niedawno przeszedł przeszczep, ryzyko koinfekcji i stosowanie wielu antybiotyków. Wyniki dotyczące minimalnych stężeń hamujących (MIC) karbapenemu mogą lepiej przewidywać wyniki kliniczne pacjentów niż obecna kategoryczna klasyfikacja MIC wymienionych jako wrażliwe, pośrednie lub oporne. Badanie miało na celu określenie wartości granicznej śmiertelności szpitalnej z jakiejkolwiek przyczyny dla MIC karbapenemu, które zostały dostosowane do czynników ryzyka. Kolejnym celem było ustalenie, czy istnieje podobny punkt przerwania dla wyników pośrednich, takich jak czas do śmierci i długość pobytu po zakażeniu dla osób, które przeżyły. Uwzględniono 71 pacjentów, z których 52 przeżyło, a 19 zmarło. Klasyfikacja i analiza drzewa regresji pozwoliły ustalić podział MIC organizmu między 2 a 4 mg/litr i przewidywane różnice w śmiertelności (16,1% dla dawki 2 mg/litr w porównaniu z 76,9% dla dawki 4 mg/litr). W regresji logistycznej uwzględniającej czynniki zakłócające każde podwójne rozcieńczenie MIC imipenemu podwajało prawdopodobieństwo zgonu. Ten schemat klasyfikacji prawidłowo przewidział 82,6% przypadków. Pacjentów odpowiednio stratyfikowano do wartości MIC ≤2 mg/litr (58 pacjentów) i ≥4 mg/litr (13 pacjentów). Chorzy z grupy z MIC ≥4 mg/litr byli bardziej chorzy. Wyniki drugorzędne były również podobne między grupami. Pacjenci z organizmami, które miały MIC ≥4 mg/litr mieli gorsze wyniki niż ci z izolatami o MIC ≤2 mg/litr.
W New York Presbyterian Hospital , będącym częścią Columbia University Medical Center w Nowym Jorku, przeprowadzono badanie dotyczące znacznego wzrostu oporności K. pneumoniae na karbapenemy w latach 1999-2007. Po pozytywnym posiewie krwi pacjenta ogólna śmiertelność wynosiła 23% w ciągu 7 dni, 42% w ciągu 30 dni i 60% do końca hospitalizacji. Ogólna śmiertelność wewnątrzszpitalna wyniosła 48%.
W Soroka Medical Center , izraelskim uniwersyteckim szpitalu klinicznym, przeprowadzono badanie między październikiem 2005 a październikiem 2008 w celu określenia bezpośredniego wskaźnika śmiertelności związanego z zakażeniami krwi K. pneumoniae opornymi na karbapenemy. Surowa śmiertelność osób z oporną bakteriemią wynosiła 71,9%, a przypisana śmiertelność została określona na 50% z 95% przedziałem ufności. Surowa śmiertelność dla osób kontrolnych wynosiła 21,9%. W wyniku przeprowadzonych badań Centrum Medyczne Soroka rozpoczęło intensywny program mający na celu zapobieganie rozprzestrzenianiu się karbapenemoopornych K. pneumoniae.
Badanie retrospektywne przeprowadzone w 2013 r. w Centrum Medycznym Shaare Zedek, obejmujące pacjentów z infekcjami dróg moczowych (bakteriomoczem) wywołanymi przez oporne na karbapenemy Klebsiella pneumoniae (CRKp), nie wykazało statystycznie istotnej różnicy we wskaźnikach śmiertelności w porównaniu z pacjentami z bakteriomoczem wywołanym przez wrażliwe na karbapenemy K. pneumoniae ( CSKp). Śmiertelność na poziomie 29% obserwowano u pacjentów z zakażeniem CRKp w porównaniu z 25% śmiertelnością u pacjentów z zakażeniami CSKp, które wytwarzały beta-laktamazę o rozszerzonym spektrum działania (ESBL). Oba wskaźniki śmiertelności były znacznie wyższe niż u pacjentów z urosepsą lekowrażliwą . Większość pacjentów biorących udział w badaniu cierpiała na inne choroby, w tym demencję , upośledzenie odporności , niewydolność nerek lub cukrzycę . Głównym czynnikiem ryzyka zgonu stwierdzonym w badaniu było przykucie do łóżka, co znacznie zwiększało ryzyko zgonu. Sugeruje to, że zgony były spowodowane innymi przyczynami niż bakteriuria. Całkowity czas hospitalizacji był nieco dłuższy u pacjentów z zakażeniem CRKp (28 ± 33 dni w porównaniu do 22 ± 28 dni u pacjentów z zakażeniem CSKp).
W badaniu kliniczno-kontrolnym obejmującym 99 pacjentów w porównaniu z 99 grupą kontrolną w Mount Sinai Hospital (Manhattan) , szpitalu uniwersyteckim posiadającym 1171 łóżek, 38% pacjentów objętych opieką długoterminową dotkniętych CRE zmarło z powodu zakażenia K. pneumoniae . U pacjentów występowały czynniki ryzyka, w tym cukrzyca, zakażenie wirusem HIV, choroby serca, choroby wątroby, przewlekła choroba nerek , jeden był biorcą przeszczepu. 72% pacjentów, którzy zostali wypisani ze szpitala z CRE, zostało ponownie przyjętych w ciągu 90 dni. Badanie przeprowadzone w 2008 roku na Mount Sinai wykazało wyniki związane z Klebsiella pneumoniae opornymi na karbapenemy, w których pacjenci wymagający przeszczepu narządu lub komórek macierzystych, wentylacji mechanicznej, przedłużonej hospitalizacji lub wcześniejszego leczenia karbapenemami mieli zwiększone prawdopodobieństwo zakażenia karbapenemami. oporne K. pneumoniae . Połączenie antybiotyków zadziałało w leczeniu infekcji, a wskaźniki przeżywalności zakażonych pacjentów wzrosły, gdy ognisko infekcji zostało usunięte.
Infekcje CRE mogą wystąpić w ciągu około 12 dni po przeszczepie wątroby, a 18% tych pacjentów zmarło rok po przeszczepie w badaniu z 2012 roku.
Implikacje dla zdrowia publicznego
Przeżywalność bakterii na powierzchniach
Badania wykazały przedłużoną żywotność bakterii na powierzchniach ze stali nierdzewnej w temperaturze pokojowej. W specyficznym badaniu stal nierdzewną zaszczepiono 107 CFU /cm2 E. coli i K. pneumonia , zawierającymi odpowiednio bla CTX-M-15 i bla NDM-1 (geny oporności na antybiotyki). Trzydzieści dni później (w temperaturze pokojowej, 22°C) 104 żywotnych komórek; a po 100 dniach pozostało 100 CFU/ cm2 E. coli .
Z kolei na powierzchniach miedzi i jej stopów obserwuje się szybką śmierć szczepów bakteryjnych opornych na antybiotyki, a także zniszczenie plazmidowego i genomowego DNA. Badania sugerują, że narażenie na suche powierzchnie miedziane hamuje oddychanie i wzrost producentów poprzez uwalnianie jonów miedzi.
Zwiększony poziomy transfer genów (HGT) obserwuje się jednocześnie z żywotnością komórek na powierzchniach ze stali nierdzewnej. HGT jest jednym z głównych czynników odpowiedzialnych za powstawanie antybiotykooporności u bakterii. Sugeruje to, że natychmiastowe odkażanie powierzchni jest ważne w zapobieganiu rozprzestrzeniania się genów oporności na antybiotyki. Wykazano również, że poziomy transfer genów β-laktamazy opornej na antybiotyki nie występuje na powierzchniach z miedzi przeciwdrobnoustrojowej. Ponieważ powierzchnie miedzi degradują nagie DNA (i DNA plazmidu w opornych na antybiotyki E. coli i K. zapalenie płuc ), powierzchnie miedziane zatrzymałyby HGT.
Wykazano, że poziomy transfer genów zachodzi łatwo na suchych powierzchniach, takich jak stal nierdzewna, ale nie na powierzchniach z miedzi i stopów miedzi. Szybkość śmierci bakterii wzrastała proporcjonalnie do procentowej zawartości miedzi w powierzchni stopu miedzi. Może to być bardzo ważne w przyszłych warunkach klinicznych i społecznych, ponieważ zwiększenie wykorzystania miedzi w wyposażeniu sal szpitalnych może pomóc w znacznym ograniczeniu rozprzestrzeniania się infekcji opornych na antybiotyki i poziomego transferu genów tej oporności na antybiotyki.
Zobacz też
Dalsza lektura
- 2012 CRE Toolkit – Wytyczne dotyczące zwalczania opornych na karbapenemy Enterobacteriaceae (CRE) CDC Zakażenia związane z opieką zdrowotną, marzec 2013 r.
- Wytwarzające karbapenemazy Enterobacteriaceae (CPE) dotykają pacjentów szpitali Manchester Royal Infirmary wykryto superbakterię znaną jako Enterobacteriaceae wytwarzające karbapenemazy, znaną w skrócie jako CPE