Erawacyklina
|
|
| Nazwy | |
|---|---|
|
Preferowana nazwa IUPAC
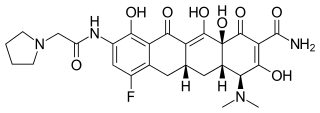
(4S , 4aS , 5aR , 12aS ) -4-(dimetyloamino)-7-fluoro-3,10,12,12a-tetrahydroksy-1,11-diokso-9-[2-(pirolidyn-1- ylo)acetamido]-1,4,4a,5,5a,6,11,12a-oktahydrotetraceno-2-karboksyamid |
|
| Inne nazwy Xerava
|
|
| Identyfikatory | |
|
Model 3D ( JSmol )
|
|
| ChemSpider | |
| KEGG | |
|
Identyfikator klienta PubChem
|
|
| UNII | |
|
|
|
|
| Nieruchomości | |
| C 27 H 31 FN 4 O 8 | |
| Masa cząsteczkowa | 558.555 |
| Farmakologia | |
| J01AA13 ( KTO ) | |
|
O ile nie zaznaczono inaczej, dane podano dla materiałów w stanie normalnym (przy 25°C [77°F], 100 kPa).
|
|
Erawacyklina (TP-434, Xerava ) jest syntetycznym fluorowcowanym antybiotykiem klasy tetracyklin firmy Tetraphase Pharmaceuticals. Jest blisko spokrewniony z tygecykliną . Ma szerokie spektrum działania obejmujące wiele szczepów bakterii opornych na wiele leków . Niedawno zakończono badania fazy III dotyczące powikłanych zakażeń w obrębie jamy brzusznej (cIAI) i powikłanych zakażeń dróg moczowych (cUTI) z mieszanymi wynikami. Erawacyklina otrzymała szybkiej ścieżki od FDA i jest obecnie dostępna w USA.
Zastosowania medyczne
Erawacyklina wykazuje szerokie spektrum działania przeciwko różnym bakteriom Gram-dodatnim i Gram-ujemnym, w tym szczepom wielolekoopornym, takim jak oporny na metycylinę Staphylococcus aureus (MRSA) i oporny na karbapenemy Enterobacteriaceae . Obecnie opracowuje się preparat do podawania dożylnego i doustnego.
Spektrum aktywności
Organizmy Gram-dodatnie
- Staphylococcus aureus (zarówno szczepy oporne na metycylinę, jak i wrażliwe)
- Streptococcus pneumoniae
- Enterococcus faecalis
- Enterococcus faecium (w tym szczepy oporne na wankomycynę )
Organizmy Gram-ujemne
- Acinetobacter baumannii
- Stenotrophomonas maltophilia
- Haemophilus influenzae
- Moraxella catarrhalis
- Neisseria gonorrhoeae
-
Enterobacteriaceae
- Escherichia coli (w tym szczepy wytwarzające ESBL )
- Klebsiella pneumoniae (w tym szczepy oporne na karbapenemy)
- Klebsiella oxytoca
- Gatunek Enterobacter
- gatunek Citrobacter
- Proteus mirabilis
- Serratia marcescens
Podobnie jak inne pochodne tetracykliny, erawacyklina jest słabo aktywna wobec Pseudomonas aeruginosa z MIC 90 = 16 μg/ml (zakres 0,06-64 μg/ml) . Erawacyklina zachowuje in vitro aktywność przeciwko Enterobacteriaceae niosącym gen mcr-1 odpowiedzialny za oporność na polimyksynę b / kolistynę .
Badania kliniczne
Informacje o bieżących i przeszłych badaniach klinicznych: https://clinicaltrials.gov/ct2/results?cond=&term=eravacycline&cntry1=&state1=&recrs=
Próby fazy 3
Powikłane zakażenia w obrębie jamy brzusznej (IGNITE 1)
Badanie IGNITE 1 porównywało erawacyklinę dożylną dwa razy dziennie z ertapenemem podawanym raz dziennie w leczeniu cIAI. Do badania włączono łącznie 541 pacjentów i wykazano, że erawacyklina nie jest gorsza od ertapenemu. Dodatkowe kluczowe badanie fazy 3 (IGNITE 4) planowane jest na koniec 2016 r., a wstępne wyniki będą prawdopodobnie dostępne w czwartym kwartale 2017 r.
Powikłane infekcje w obrębie jamy brzusznej (IGNITE 4)
W badaniu IGNITE 4 oceniano erawacyklinę podawaną dożylnie dwa razy dziennie (1,0 mg/kg co 12 godzin) w porównaniu z osobami otrzymującymi meropenem (1 g co 8 godzin). Do badania włączono 500 dorosłych pacjentów, a głównym punktem końcowym była odpowiedź kliniczna podczas wizyty kontrolnej, która miała miejsce 25–31 dni po podaniu dawki początkowej. Pierwotną analizę skuteczności przeprowadzono z zastosowaniem 12,5% marginesu równoważności w mikrobiologicznej populacji zaplanowanej do leczenia (micro-ITT).
W dniu 25 lipca 2017 r. firma farmaceutyczna Tetraphase opublikowała w prasie najlepsze dane, z których wynika, że wskaźniki wyleczeń klinicznych w populacji mikro-ITT wynoszą odpowiednio 90,8% i 91,2% dla erawacykliny (n=195) i meropenemu (n=205) (95% CI: -6,3%,5,3%). Analizę pierwotną przeprowadzono z zastosowaniem 12,5% marginesu równoważności zmodyfikowanej populacji pacjentów z zamiarem leczenia (MITT) i populacji pacjentów podlegających ocenie klinicznej (CE). Wskaźniki wyleczeń klinicznych w populacji MITT wyniosły odpowiednio 92,4% i 91,6% dla erawacykliny (n=250) i meropenemu (n=249) (95% CI: -4,1%, 5,8%). Wskaźniki wyleczeń klinicznych w populacji CE wyniosły odpowiednio 96,9% i 96,1% dla erawacykliny (n=225) i meropenemu (n=231) (95% CI: -2,9%, 4,5%). Erawacyklina osiągnęła pierwszorzędowe punkty końcowe skuteczności zgodnie z wytycznymi FDA i EMA. Wtórne analizy były zgodne i potwierdzały główny wynik według Tetraphase. W badaniu nie wystąpiły poważne zdarzenia niepożądane związane z leczeniem (SAE). Częstość zdarzeń niepożądanych związanych z leczeniem (TEAE) była podobna w obu leczonych grupach, przy czym najczęściej zgłaszanymi zdarzeniami niepożądanymi związanymi z lekiem (AE) erawacykliny były reakcje w miejscu wlewu, nudności i wymioty, z których każde występowało z częstością mniejszą niż 5%. Najczęstszymi patogenami Gram-ujemnymi w badaniu były Escherichia coli , Klebsiella pneumoniae , Pseudomonas i Bacteroides . Pełne dane z IGNITE4 będą dostępne, gdy firma będzie przygotowywać się do złożenia wniosku o nowy lek (NDA) w pierwszym kwartale 2018 r. w leczeniu powikłanych zakażeń w obrębie jamy brzusznej Erawacykliną.
Powikłane zakażenia dróg moczowych (IGNITE 2)
W badaniu IGNITE 2 porównywano 7-dniową terapię erawacykliny dożylnie z lewofloksacyną dożylnie z możliwością zamiany pacjentów z obu grup na terapię doustną po 3 dniach z powodu cUTI. Ogólnie erawacylina była gorsza od lewofloksacyny pod względem wskaźnika odpowiedzi (60,4 vs 66,9%); jednak zauważono, że pacjenci, którzy ukończyli terapię preparatem IV, mieli wyższe wskaźniki odpowiedzi, co sugeruje problemy z preparatem w przypadku opcji doustnej. Ze względu na skuteczność preparatu dożylnego planowane jest dodatkowe badanie fazy 3 w celu wsparcia dodatkowej NDA dla wskazania cUTI.
Powikłane infekcje dróg moczowych (IGNITE 3)
IGNITE3 jest obecnie w toku, począwszy od stycznia 2017 r., a zakończenie spodziewane jest w grudniu 2018 r. Badanie to ocenia skuteczność erawacykliny podawanej dożylnie (1,5 mg/kg co 24 godziny) w porównaniu z ertapenemem (1 g co 24 godziny) w leczeniu cUTI. IGNITE3 rejestruje obecnie około 1000 pacjentów, którzy zostaną losowo przydzieleni w stosunku 1:1 do grupy otrzymującej dożylnie erawacyklinę lub ertapenem przez co najmniej 5 dni, a następnie będą kwalifikować się do przejścia na doustną lewofloksacynę . Pierwszorzędowymi punktami końcowymi są Odsetek uczestników mikrobiologicznej populacji zaplanowanej do leczenia (mikro-ITT), wykazujący wyleczenie kliniczne i sukces mikrobiologiczny na koniec wizyty dożylnej (EOI) [Przedział czasowy: wizyta EOI (w ciągu 1 dnia od zakończenia dożylne leczenie badanym lekiem) ] oraz Odsetek uczestników w populacji mikro-ITT wykazujących wyleczenie kliniczne i sukces mikrobiologiczny podczas wizyty testowej (TOC) [Przedział czasowy: wizyta TOC (14–17 dni po randomizacji)]. Z badaniem drugorzędowych punktów końcowych (wyników) Odsetek uczestników mikrobiologicznej zmodyfikowanej populacji zaplanowanej do leczenia (micro-MITT) i populacji podlegającej ocenie mikrobiologicznej (ME), wykazującej sukces mikrobiologiczny podczas wizyty TOC [Przedział czasowy: wizyta TOC (14–17 dni po randomizacji)]
Informacje handlowe
Erawacyklina jest opracowywana przez Tetraphase Pharmaceuticals Inc. Jest sprzedawana pod nazwą handlową Xerava w Stanach Zjednoczonych.
- ^ ab Solomkin , Józef; Evans, Dawid; Slepavicius, Algirdas; Lee, Patryk; Marsz, Andrzej; Tsai, Larry; Sutcliffe, Joyce A.; Róg, Patrick (2016-11-16). „Ocena skuteczności i bezpieczeństwa erawacykliny w porównaniu z ertapenemem w powikłanych zakażeniach wewnątrzbrzusznych w badaniu zakażeń Gram-ujemnych leczonych erawacykliną (IGNITE 1): randomizowane badanie kliniczne”. Chirurgia JAMA . 152 (3): 224–232. doi : 10.1001/jamasurg.2016.4237 . ISSN 2168-6262 . PMID 27851857 . S2CID 42977246 .
- ^ a b „Tetraphase ogłasza najlepsze wyniki badania klinicznego IGNITE2 fazy 3 Erawacykliny w cUTI (NASDAQ: TTPH)” . ir.tphase.com . Zarchiwizowane od oryginału w dniu 2016-11-21 . Źródło 2016-11-20 .
- ^ „FDA przyznaje oznaczenie QIDP Erawacyklinie, wiodącemu kandydatowi na antybiotyk Tetraphase | Business Wire” . businesswire.com . 2013-07-15 . Źródło 2016-11-20 .
- ^ a b Zhanel, George G.; Cheung, Doris; Adam, Heather; Zelenitsky, Sheryl; Złota, Alyssa; Schweizer, Frank; Gorityala, Bala; Lagacé-Wiens, Philippe RS; Walkty, Andrew (2016-04-01). „Przegląd Erawacykliny, nowego środka przeciwbakteryjnego fluorocykliny”. Narkotyki . 76 (5): 567–588. doi : 10.1007/s40265-016-0545-8 . ISSN 1179-1950 . PMID 26863149 . S2CID 36285428 .
- ^ Sutcliffe, JA; O'Brien, W.; Fyfe, C.; Grossman, TH (2013-11-01). „Antybakteryjne działanie erawacykliny (TP-434), nowej fluorocykliny, przeciwko patogenom szpitalnym i społecznym” . Środki przeciwdrobnoustrojowe i chemioterapia . 57 (11): 5548–5558. doi : 10.1128/AAC.01288-13 . ISSN 1098-6596 . PMC 3811277 . PMID 23979750 .
- ^ Solomkin, Józef S.; Ramesh, Mayakonda Krishnamurthy; Cesnauskas, Gintaras; Nowikow, Nikolajs; Stefanowa, Penka; Sutcliffe, Joyce A.; Walpole, Susannah M.; Róg, Patrick T. (2014-01-01). „Faza 2, randomizowane badanie z podwójnie ślepą próbą skuteczności i bezpieczeństwa dwóch schematów dawkowania erawacykliny w porównaniu z ertapenemem w pozaszpitalnych powikłanych zakażeniach w obrębie jamy brzusznej u dorosłych” . Środki przeciwdrobnoustrojowe i chemioterapia . 58 (4): 1847–1854. doi : 10.1128/AAC.01614-13 . ISSN 1098-6596 . PMC 4023720 . PMID 24342651 .
- ^ Abdallah, Marie; Olafisoye, Olawole; Cortes, Christopher; Urban, Carl; Landman, Dawid; Quale, John (2015-03-01). „Aktywność erawacykliny przeciwko Enterobacteriaceae i Acinetobacter baumannii, w tym izolaty wielolekooporne, z Nowego Jorku” . Środki przeciwdrobnoustrojowe i chemioterapia . 59 (3): 1802–1805. doi : 10.1128/AAC.04809-14 . ISSN 1098-6596 . PMC 4325809 . PMID 25534744 .
- Bibliografia _ LeBlanc, Gabrielle; Zamknij, Brianno; Nordmann, Patrice; Dumas, Jacques; Grossman, Trudy H. (22.08.2016). „Erawacyklina jest aktywna przeciwko bakteryjnym izolatom wykazującym ekspresję genu oporności na polimyksynę mcr-1” (PDF) . Środki przeciwdrobnoustrojowe i chemioterapia . 60 (11): 6989–6990. doi : 10.1128/AAC.01646-16 . ISSN 0066-4804 . PMC 5075126 . PMID 27550359 .
- ^ „Próba fazy 3 IGNITE4 mająca na celu zbadanie bezpieczeństwa i skuteczności erawacykliny podawanej dożylnie w cIAI” . Healio . 2016-10-19 . Źródło 2023-01-16 .
- ^ a b „Tetraphase Pharmaceuticals zapewnia aktualizację statusu regulacyjnego i rozwoju erawacykliny (NASDAQ:TTPH)” . ir.tphase.com . Zarchiwizowane od oryginału w dniu 2016-11-21 . Źródło 2016-11-20 .
- ^ a b c „Tetraphase ogłasza pozytywne wyniki badania klinicznego fazy 3 IGNITE4 w powikłanych zakażeniach w obrębie jamy brzusznej (NASDAQ: TTPH)” . ir.tphase.com . Zarchiwizowane od oryginału w dniu 2017-08-01 . Źródło 2017-07-27 .
- ^ a b „Badanie skuteczności i bezpieczeństwa erawacykliny w porównaniu z meropenemem w powikłanych zakażeniach w obrębie jamy brzusznej — widok pełnego tekstu — ClinicalTrials.gov” . www.clinicaltrials.gov . Źródło 2017-07-27 .
- ^ „IGNITE2: Erawacyklina gorsza od lewofloksacyny, ale preparat dożylny jest obiecujący” . Healio . 2016-07-08 . Źródło 2023-01-16 .
- ^ a b „Badanie skuteczności i bezpieczeństwa erawacykliny w porównaniu z ertapenemem u uczestników z powikłanymi zakażeniami dróg moczowych — widok pełnego tekstu — ClinicalTrials.gov” . www.clinicaltrials.gov . Źródło 2017-07-27 .
- ^ a b „Tetraphase Pharmaceuticals Dawkuje Pierwszemu Pacjentowi w IGNITE3 Fazie 3 Badania Klinicznego Erawacykliny podawanej raz dziennie dożylnie w cUTI (NASDAQ:TTPH)” . ir.tphase.com . Zarchiwizowane od oryginału w dniu 2017-08-07 . Źródło 2017-07-27 .
Linki zewnętrzne
- „Tetraphase ogłasza najlepsze wyniki z badania klinicznego IGNITE2 fazy 3 Erawacykliny w cUTI: Erawacyklina nie osiągnęła pierwszorzędowego punktu końcowego w kluczowej części próby cUTI”
- Rurociąg tetrafazowy
- Proces badawczo-rozwojowy erawacykliny: pierwsza w pełni syntetyczna fluorocyklina w rozwoju klinicznym