Integrazon

|
|
| Nazwy | |
|---|---|
|
Preferowana nazwa IUPAC
(1aR , 2R , 5R , 6R , 6aS ) -6-heksylo-2,6-dihydroksy-2,5,6,6a-tetrahydrooksyreno[2,3- f ][2]benzofuran-3( 1a H )-jeden |
|
| Inne nazwy (+)-integrazon
|
|
| Identyfikatory | |
|
|
|
Model 3D ( JSmol )
|
|
| CHEMBL | |
| ChemSpider | |
|
Identyfikator klienta PubChem
|
|
| UNII | |
|
Pulpit nawigacyjny CompTox ( EPA )
|
|
|
|
|
|
| Nieruchomości | |
| C14H20O5 _ _ _ _ _ | |
| Masa cząsteczkowa | 268,309 g·mol -1 |
|
O ile nie zaznaczono inaczej, dane podano dla materiałów w stanie normalnym (przy 25°C [77°F], 100 kPa).
|
|
Integrazon jest naturalnym produktem poliketydowym , wyizolowanym z nieznanego grzyba, który, jak wykazano, hamuje enzym integrazy HIV-1 .
Występowanie
Integrazon występuje naturalnie w niezidentyfikowanym sterylnym grzybie. Grzyb ten otrzymał etykietę MF6836 od badaczy firmy Merck i był hodowany na wermikulitu , AD2. Ekstrakt metyloetyloketonowy z wzrostu grzybów na Sephadex LH 20 ( pożywka do chromatografii cieczowej przeznaczona do rozdzielania małych produktów naturalnych) został następnie poddany zarówno chromatografii żelowo-permeacyjnej, jak i wysokosprawnej chromatografii cieczowej w celu wyizolowania integrazonu, który został oddzielony w postaci amorficznej proszek w stężeniu 1,8 g/L.
Aktywność biologiczna
Integrazon hamuje integrazę HIV-1, wirusowy enzym odpowiedzialny za integrację prowirusa HIV z genomem gospodarza . Integraza osiąga to za pomocą dwóch reakcji: przetwarzania 3-pierwszego końca i reakcji przeniesienia nici. W pierwszej z tych dwóch reakcji wirusowy DNA jest przetwarzany przez usunięcie dwóch deoksynukleotydów. W reakcji przenoszenia nici te przetworzone końce 3-prime wirusowego DNA są kowalencyjnie związane z chromosomalnym DNA gospodarza. Integrazon hamuje aktywność integrazy wirusa HIV poprzez zakłócanie reakcji przeniesienia nici, z IC50 ( połowa maksymalnego stężenia hamującego) wynoszącym 41 μM. [ potrzebne źródło ]
Ze względu na wysoki wskaźnik mutacji i systematyczną eliminację kluczowych komórek układu odpornościowego, HIV jest wirusem bardzo trudnym do stworzenia szczepionki. W niektórych badaniach grupy otrzymujące eksperymentalne szczepionki przeciw HIV miały w rzeczywistości większą częstość zakażenia wirusem HIV niż grupy otrzymujące placebo. Ponieważ szczepienia, tradycyjna metoda walki z chorobami wirusowymi, są w dużej mierze niedostępne, chemioterapia staje się lepszą opcją. Niestety, niezwykle wysoki wskaźnik mutacji wirusa HIV pozwala mu ewoluować w celu uniknięcia zarówno ludzkiego układu odpornościowego, jak i działania leków przeciwwirusowych. Z tego powodu potrzebne są nowe leki przeciwwirusowe HIV-1, aby kontynuować walkę z HIV. Metoda inaktywacji, którą stosuje integrazon, wydaje się obiecująca w powstrzymaniu rozprzestrzeniania się wirusa HIV u gospodarza, chociaż nie wyeliminuje całkowicie wirusa. [ potrzebne źródło ]
Synteza
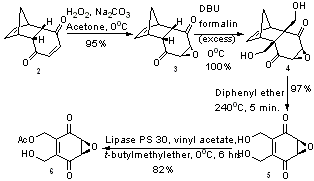
Opracowano całkowitą laboratoryjną syntezę integrazonu, wychodząc z powszechnie dostępnego adduktu Dielsa-Aldera p-benzochinonu i cyklopentadienu . Stosując epoksydowania , w której pośredniczy zasada , uzyskano strukturę 3, która po wyczerpującej hydroksymetylacji w obecności DBU doprowadziła do struktury 4 . Tworzenie struktury 4 jest szczególnie imponujące – nie tylko tworzy dwa ważne wiązania CC w jednym kroku, ale także zachodzi z wydajnością ilościową. Stosując retroreakcję Dielsa-Aldera , utworzono strukturę 5 z wydajnością zbliżoną do ilościowej. Strukturę 5 desymetryzowano przez enzym transestryfikacji , z użyciem immobilizowanego enzymu lipazy PS 30, dając strukturę 6, która powstała z 99% nadmiarem enancjomerycznym .
Stereochemię grupy hydroksylowej przy węglu 6 w końcowej cząsteczce integrazonu (3) określono metodą redukcji, która była zarówno regio, jak i stereoselektywna ze względu na kierunkowe działanie pierwszorzędowej grupy hydroksylowej (węgiel 8) i pierścienia epoksydowego ( węgle 4 i 5). Grupa hydroksylowa na węglu 8 jest następnie selektywnie zabezpieczana eterem trietylosililu (TES), otrzymując strukturę 8. Z zabezpieczonymi grupami hydroksylowymi na obu węglach 1 i 8, stosunkowo łatwo jest stereoselektywnie zredukować grupę karbonylową na węglu 3 za pomocą borowodorek sodu otrzymując diol przedstawiony na strukturze 9. Zanim można było zastosować jakiekolwiek reakcje utleniania, dwie nowo utworzone grupy hydroksylowe zostały zabezpieczone jako estry octanowe , tworząc strukturę 10. Grupa zabezpieczająca TES na hydroksylu węgla 8 została usunięta bez odbezpieczania żadnej z pozostałych grup, a następnie hydroksyl węgla 8 utleniono PCC , otrzymując aldehyd pokazany w strukturze 11.
Kolejnym krokiem było zainstalowanie łańcucha heksylowego na węglu aldehydowym (węgiel 8). Osiągnięto to za pomocą odczynnika Grignarda i było ono wysoce stereoselektywne – do tego stopnia, że chemicy opisujący tę reakcję wyrażają „zachwyt”. Spekuluje się, że ta stereoselektywność dla produktu 12 wynika z kierunkowego wpływu grupy octanowej przyłączonej do węgla 6, która migruje podczas reakcji do węgla 8. Niestety, w 42% produktu łańcuch alkilowy nie został zainstalowany i zamiast tego aldehyd został zredukowany z towarzyszącą migracją octanu, tworząc trioctan (struktura 14). Starano się ulepszyć ten etap syntezy, próbując zmieniać temperaturę i rozpuszczalnik. W wysokich temperaturach tworzyło się więcej trioctanu 14, podczas gdy w niskich temperaturach reakcja była powolna.
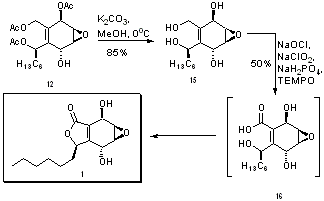
Struktura 12 jest bardzo blisko cząsteczki docelowej, 1 – pozostaje tylko zamknąć 5-członowy pierścień i utworzyć karbonyl. Hydrolizę zasady zastosowano do usunięcia pozostałych grup zabezpieczających octan, w wyniku czego tetrol przedstawiono na strukturze 15. Integrazon (1) jest następnie tworzony w jednym etapie przez utlenianie pierwszorzędowych grup hydroksylowych i skoordynowaną cyklizację elektronów w celu utworzenia pierścienia przy użyciu sodu chloryn katalizowany przez TEMPO i wybielacz. Struktura 16 to stan przejściowy zaproponowany w celu wyjaśnienia skoordynowanej reakcji elektrocyklicznej i tworzenia karbonylu.