Kwas 2,5-furandokarboksylowy

|
|
| Nazwy | |
|---|---|
|
Preferowana nazwa IUPAC
Kwas furano-2,5-dikarboksylowy |
|
| Inne nazwy Kwas dehydrośluzowy
|
|
| Identyfikatory | |
|
Model 3D ( JSmol )
|
|
| CHEBI | |
| ChemSpider | |
| Karta informacyjna ECHA | 100.019.819 |
|
Identyfikator klienta PubChem
|
|
| UNII | |
|
Pulpit nawigacyjny CompTox ( EPA )
|
|
|
|
|
|
| Nieruchomości | |
| C6H4O5 _ _ _ _ _ | |
| Masa cząsteczkowa | 156,093 g·mol -1 |
| Wygląd | Białe ciało stałe |
| Gęstość | 1,604 g/ cm3 |
| Temperatura topnienia | 342 ° C (648 ° F; 615 K) |
| Temperatura wrzenia | 420 ° C (788 ° F; 693 K) |
| rozpuszczalny w DMSO | |
| Kwasowość ( p Ka ) | 4,38, 5,85 |
| Zagrożenia | |
| Punkt zapłonu | 207 ° C (405 ° F; 480 K) |
|
O ile nie zaznaczono inaczej, dane podano dla materiałów w stanie normalnym (przy 25°C [77°F], 100 kPa).
|
|
Kwas 2,5-furanokarboksylowy (FDCA) to organiczny związek chemiczny składający się z dwóch grup kwasu karboksylowego przyłączonych do centralnego pierścienia furanu . Po raz pierwszy został opisany jako kwas dehydrośluzowy przez Rudolpha Fittiga i Heinzelmanna w 1876 r., Którzy wytworzyli go poprzez działanie stężonego kwasu bromowodorowego na kwas śluzowy . Może być wytwarzany z niektórych węglowodanów i jako taki jest zasobem odnawialnym, został określony przez Departament Energii Stanów Zjednoczonych jako jeden z 12 priorytetowych związków chemicznych dla stworzenia „zielonej” chemii przyszłości. Sugerowano, że kwas furano-2,5-dikarboksylowy (FDCA) jest ważnym odnawialnym budulcem, ponieważ może zastąpić kwas tereftalowy (PTA) w produkcji poliestrów i innych obecnych polimerów zawierających ugrupowanie aromatyczne.
Synteza FDCA
Metody syntezy FDCA można podzielić na cztery grupy:
- Odwadnianie pochodnych heksozy
- Utlenianie 2,5-dipodstawionych furanów
- Konwersje katalityczne różnych pochodnych furanów
- Biologiczna konwersja HMF
Odwadnianie pochodnych heksozy
Pierwsza grupa opiera się na potrójnej dehydratacji kwasu aldarowego ( śluzowego ). Ta reakcja wymaga surowych warunków (kwasy o wysokim stężeniu, temp. > 120°C, czas reakcji > 20h), a wszystkie metody były nieselektywne z wydajnością < 50%. Proces ten został również opatentowany przez francuską firmę Agro Industrie Recherches et Developpements. Jest to również proces stosowany przez firmy DuPont i ADM zgodnie z literaturą patentową.
Utlenianie 2,5-dipodstawionych furanów
Druga klasa dróg syntezy obejmuje reakcje utleniania różnych 2,5-dipodstawionych furanów z wykorzystaniem różnych utleniaczy nieorganicznych. Zgłoszono kilka dróg do FDCA poprzez utlenianie hydroksymetylofurfuralu (HMF) powietrzem na różnych katalizatorach. Utlenianie HMF w silnie alkalicznych warunkach na katalizatorach z metali szlachetnych daje prawie ilościowe tworzenie FDCA. Utlenianie HMF i metoksymetylofurfuralu (MMF) badano również za pomocą szeregu konwencjonalnych katalizatorów bromkowych metali (Co, Mn, Br) stosowanych do utleniania para-ksylenu do kwasu tereftalowego . Również bezpośrednie odwadnianie w jednym naczyniu i utlenianie fruktozy do FDCA przez pośredni HMF badano z dobrą selektywnością, niestety system ten nie działa w wodzie.
Konwersje katalityczne różnych pochodnych furanów
Trzecia klasa obejmuje reakcje opisujące syntezę FDCA z furfuralu. Furfural można utlenić do kwasu 2-furoesowego za pomocą kwasu azotowego , który następnie przekształcono w jego ester metylowy. Ester następnie przekształcono przez chlorometylowanie w pozycji 5, otrzymując 5-chlorometylofuroinian. Ten ostatni został utleniony kwasem azotowym z wytworzeniem 2,5-furanodikarboksylanu dimetylu, który po alkalicznej hydrolizie dał FDCA z 50% wydajnością. Andrisano poinformował, że 2-furoinian potasu po podgrzaniu do 300 ° C w atmosferze azotu ulega dekarboksylacji do furanu z jednoczesną karboksylacją w pozycji 5 do 2,5-furanodikarboksylanu dipotasu.
Biologiczna konwersja HMF
FDCA wykryto również w ludzkim moczu. Zdrowy człowiek wytwarza 3-5 mg dziennie. Podjęto liczne badania mające na celu ustalenie metabolizmu tego związku oraz określenie ilości, która jest wytwarzana w zależności od stanu zdrowia człowieka. Wykazano, że po wstrzyknięciu fruktozy wzrosła indywidualna ilość produkowanego FDCA. FDCA wykryto również w osoczu krwi. Cupriavidus basilensis HMF14 wyizolowano enzym furfural/oksydoreduktaza HMF . Enzym ten może być w stanie przekształcić HMF w FDCA przy użyciu tlenu cząsteczkowego, chociaż dehydrogenaza aldehydowa może również odgrywać pewną rolę. Szczep Pseudomonas putida , który został zmodyfikowany genetycznie w celu ekspresji tego enzymu, może całkowicie i selektywnie przekształcić HMF w FDCA. Ta biokataliza jest przeprowadzana w wodzie, w temperaturze i ciśnieniu otoczenia, bez toksycznych lub zanieczyszczających chemikaliów, co czyni ją bardzo przyjazną dla środowiska. Później opisano kilka innych enzymów, w tym HMFO. Ta oksydaza zależna od flawiny katalizuje trzy kolejne utleniania, tworząc FDCA z HMF.
Produkcja przemysłowa
DuPont ogłosił produkcję FDCA do użytku w PTF. W 2011 roku Avantium jako pierwsza firma zbudowała zakład pilotażowy FDCA w Geleen w Holandii. Avantium w pełni sprawdziło swoją technologię produkcji FDCA w tym zakładzie pilotażowym, a obecnie planuje otwarcie pierwszego na świecie komercyjnego zakładu FDCA. Obecnie Avantium rozpoczęło budowę komercyjnego zakładu 5kt FDCA w Delfzijl w Holandii. Zakład zostanie ukończony pod koniec 2023 roku, a produkcja komercyjna rozpocznie się na początku 2024 roku. Podpisano dziesięć umów odbioru.
Właściwości i konwersje
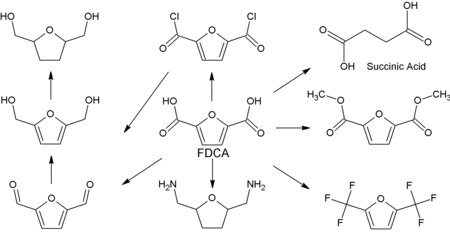
FDCA jest bardzo stabilnym związkiem. Jego właściwości fizyczne, takie jak nierozpuszczalność w większości popularnych rozpuszczalników i bardzo wysoka temperatura topnienia (topi się w temperaturze 342 ° C), wydają się wskazywać na międzycząsteczkowe wiązania wodorowe. Pomimo swojej stabilności chemicznej FDCA ulega reakcjom typowym dla kwasów karboksylowych, takim jak podstawienie fluorowca do dihalogenków karboksylowych, tworzenie diestrów i tworzenie amidów. Wszystkie te reakcje zostały opracowane pod koniec XIX i na początku XX wieku. Nowsze metody opisali Janda i wsp., wprowadzając syntezę dichlorku 2,5-furanodikarboksylowego w reakcji FDCA z chlorkiem tionylu. Synteza estru dietylowego i dimetylowego oraz amidowanie i kilka innych modyfikacji zostało zgłoszone. Wszechstronność FDCA jest również widoczna w liczbie pochodnych dostępnych dzięki stosunkowo prostym przemianom chemicznym. Selektywna redukcja może prowadzić do częściowo uwodornionych produktów, takich jak 2,5-dihydroksymetylofuran, i całkowicie uwodornionych materiałów, takich jak 2,5-bis(hydroksymetylo)tetrahydrofuran.
Aplikacje
Najważniejszą grupą konwersji FDCA jest niewątpliwie polimeryzacja. Potencjalne zastosowania bloków budulcowych na bazie furanu do polimerowych zostały obszernie przejrzane przez Gandini. Godnym uwagi przykładem jest polietyleno-2,5-furanodikarboksylan , ale w literaturze opisano także inne poliestry oraz różne poliamidy i poliuretany. Między innymi, jak Dupont i Corbion, firma Avantium twierdzi, że opracowała opłacalną metodę produkcji FDCA i pochodnych poliestrów. FDCA znalazła również zastosowanie w farmakologii. Wykazano, że jego ester dietylowy ma silne działanie znieczulające, podobne do kokainy. Wykazano, że 2,5-furanodikarboksylan diwapnia hamuje wzrost Bacillus megatorium . Badania przesiewowe anilidów pochodzących z FDCA wykazały ich ważne działanie przeciwbakteryjne. Sam dikwas jest silnym czynnikiem kompleksującym, chelatującym takie jony jak: Ca 2+ , Cu 2+ i Pb 2+ ; jest stosowany w medycynie do usuwania kamieni nerkowych. HMF jest metabolizowany przez FDCA u ssaków, w tym u ludzi. Bardzo rozcieńczony roztwór FDCA w tetrahydrofuranie stosuje się do przygotowania sztucznych żył do przeszczepów. Na początku tego rozdziału wspomniano, że FDCA jest związkiem stabilnym chemicznie. Ta właściwość została dobrze wykorzystana w przemyśle – FDCA, ponieważ większość kwasów polikarboksylowych może być składnikiem pian gaśniczych. Takie piany pomagają w krótkim czasie ugasić pożary wywołane przez polarne i niepolarne rozpuszczalniki. FDCA ma duży potencjał jako zamiennik kwasu tereftalowego, szeroko stosowanego składnika różnych poliestrów, takich jak politereftalan etylenu (PET) i politereftalan butylenu (PBT). Wszechstronność FDCA jest również widoczna w liczbie pochodnych dostępnych dzięki stosunkowo prostym przemianom chemicznym. Selektywna redukcja może prowadzić do częściowo uwodornionych produktów, takich jak 2,5-dihydroksymetylofuran, i całkowicie uwodornionych materiałów, takich jak 2,5-bis (hydroksymetylo) tetrahydrofuran. Oba te ostatnie materiały mogą służyć jako komponenty alkoholowe w produkcji nowego poliestru, a ich połączenie z FDCA prowadziłoby do nowej rodziny produktów całkowicie pochodzących z biomasy. Rozszerzenie tych koncepcji na produkcję nowych nylonów, albo poprzez reakcję FDCA z diaminami, albo poprzez konwersję FDCA do 2,5-bis(aminometylo)tetrahydrofuranu. FDCA może również służyć jako materiał wyjściowy do produkcji kwasu bursztynowego, którego użyteczność jest gdzie indziej.
Bariery techniczne
Podstawową barierą techniczną w produkcji i stosowaniu FDCA jest opracowanie efektywnego i selektywnego procesu odwadniania z cukrów. Kontrola odwadniania cukru może być bardzo potężną technologią, prowadzącą do powstania szerokiej gamy dodatkowych, niedrogich elementów budulcowych, ale nie jest jeszcze dobrze poznana. Obecnie procesy odwadniania z wykorzystaniem hydroksymetylofurfuralu (HMF) jako związku pośredniego są na ogół nieselektywne, chyba że bezpośrednio po ich utworzeniu niestabilne produkty pośrednie można przekształcić w bardziej stabilne materiały, takie jak metoksymetylofurfural (MMF). Niezbędne prace badawczo-rozwojowe obejmą opracowanie systemów selektywnego odwadniania i katalizatorów. Tworzenie FDCA będzie wymagało opracowania opłacalnej i opłacalnej przemysłowo technologii utleniania, która może współpracować z niezbędnymi procesami odwadniania.
- ^ Hopff, H. i Krieger, A. (1961), Über Decarboxylierung und Dissoziation heterocyclischer Dicarbonsäuren. HCA, 44: 1058-1063. https://doi.org/10.1002/hlca.19610440425
- ^ Fittig, Rudolph (lipiec 1876). „Ueber neue derivate der schleimsaure” [O nowych pochodnych kwasu śluzowego]. Berichte der Deutschen Chemischen Gesellschaft . Mittheilungen aus dem chemischen Institut der Universität Strassburg (w języku niemieckim). 9 (2): 1189–1199. doi : 10.1002/cber.18760090250 .
- Bibliografia _ Petersen, Gene R. (2010). „Rozwój technologii do produkcji bioproduktów z węglowodanów biorafineryjnych - ponowne odwiedzenie„ Top 10 ”Departamentu Energii Stanów Zjednoczonych”. zielona chemia . 12 (4): 539–554. doi : 10.1039/B922014C .
- ^ a b c d e f g h i Lewkowski J. 2001, Synteza, chemia i zastosowania 5-hydroksymetylo-furfuralu i jego pochodnych. ARKIVOC s. 17-54 zarchiwizowane 2011-07-19 w Wayback Machine
- ^ a b c T. Werpy, G. Petersen: Chemikalia o najwyższej wartości dodanej z biomasy. Tom I – Wyniki selekcji potencjalnych kandydatów z cukrów i gazu syntezowego. Wyprodukowane przez personel Pacific Northwest National Laboratory (PNNL); Narodowe Laboratorium Energii Odnawialnej (NREL), Biuro Programu Biomasy (EERE), 2004 ( Pobierz )
- ^ Bozell JJ, Petersen Rozwój technologii do produkcji bioproduktów z węglowodanów pochodzących z biorafinacji — ponownie odwiedzono „Top 10” Departamentu Energii Stanów Zjednoczonych. Zielony Chem 2010;12:539–554
- ^ Y. Taguchi, A. Oishi i H. Iida, Chem. Lett., 2008, 37, 50–51
- Bibliografia _
- ^ a b „DuPont Industrial Biosciences, ADM znajduje„ przełomowy proces ”dla„ długo poszukiwanej cząsteczki ”: Biofuels Digest” . www.biofuelsdigest.com . 19 stycznia 2016 . Źródło 2016-11-03 .
- Bibliografia _ N. Merat; A. Gaseta (1993). „Catalytique utleniania przez HMF en acide 2,5-furane dicarboxylique”. Dziennik katalizy molekularnej . 85 (3): 327–344. doi : 10.1016/0304-5102(93)80059-4 .
- ^ Sara E. Davisa; Levi R. Houkb; Erin C. Tamargoa; Abhaya K. Datyeb; Robert J. Davisa (2 lutego 2011). „Utlenianie 5-hydroksymetylofurfuralu w następnym terminie na katalizatorach Pt, Pd i Au na nośniku”. Kataliza dzisiaj . 160 (1): 55–60. doi : 10.1016/j.cattod.2010.06.004 .
- ^ W. Partenheimer i VV Grushin, adw. Syntezator. Katal., 2001, 343, 102–111.
- ^ C. Carlini, P. Patrono, AMR Galletti, G. Sbrana i V. Zima, Appl. Catal., A, 2005, 289, 197–204; ML Ribeiro i U. Schuchardt, Catal. Komun., 2003, 4, 83–86.
- Bibliografia _ Angeloni, AS Ann. Chim. (Rzym) 1963, 53, 1658
- ^ Witten, TA; SP Levine, M. Killan, P. Boyle i S. Harkey. Clin. chemia 1973, 19, 963
- ^ F. Koopman, N. Wierckx, JH de Winde i HJ Ruijssenaars. proc. Natl. Acad. nauka USA. 2010, 107: 4919-4924.
- ^ F. Koopman, N. Wierckx, JH de Winde i HJ Ruijssenaars. Technologia biozasobów 2010, 101: 6291-6296.
- ^ WP Dijkman, DE Groothuis, MW Fraaije. Angew. chemia Int. wyd. 2014, 53: 6515-6518.
- ^ admin. „DuPont Industrial Biosciences i ADM ogłaszają przełomową platformę technologiczną dla długo poszukiwanej cząsteczki | DuPont USA” . www.dupont.com . Źródło 2016-11-03 .
- Bibliografia _ Valenta, H.; Hrdy, I.; Hurkowa, J.; Strogl, J.; Stibor, J.; Święty, P.; Bartizal, patent J. CS, 188011 (1982); CA 1982, 97, str. 72244h.
- ^ Gandini, A., Belgacem, NM Prog. polim. Sci., 1997, 22, 1203-1379 ; Gandini, A., Silvestre, AJD, Pascoal Neto, C. Sousa, AF, Gomes, MJ Pol. Nauka: Część A: Pol. Chem., 2009, 47, 295-298; Gandini, A. Pol. chemia 1, 245-251.
- ^ „Przyszłość tworzyw sztucznych jest pochodzenia biologicznego” . www.corbion.com . Źródło 2019-08-16 .
- ^ Zastosowanie kwasu 2,5-furandokarboksylowego CAS 3238-40-2 Watson International Ltd