Podazotyn sodu
|
|
| Identyfikatory | |
|---|---|
|
Model 3D ( JSmol )
|
|
| ChemSpider | |
|
Identyfikator klienta PubChem
|
|
|
|
|
|
| Nieruchomości | |
| Na2N2O2 _ _ _ _ _ | |
| Masa cząsteczkowa | 105,99 g/mol |
| Wygląd | bezbarwne kryształy |
| Gęstość | 2,466 g/cm 3 |
| Temperatura topnienia | 100 ° C (212 ° F; 373 K) |
| Temperatura wrzenia | 335 ° C (635 ° F; 608 K) rozkłada się |
| rozpuszczalny | |
| Rozpuszczalność | nierozpuszczalny w etanolu |
|
O ile nie zaznaczono inaczej, dane podano dla materiałów w stanie normalnym (przy 25°C [77°F], 100 kPa).
|
|
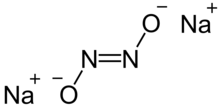
Podazotyn sodu jest stałym związkiem jonowym o wzorze Na
2 N
2 O
2 lub ( Na +
) 2 [ON=NO] 2− .
Istnieją formy cis i trans jonu podazotynowego N
2 O
2− 2 . Forma trans jest bardziej powszechna, ale można również uzyskać formę cis , która jest bardziej reaktywna niż forma trans .
izomer trans
Izomer trans jest bezbarwny i rozpuszczalny w wodzie i nierozpuszczalny w etanolu i eterze .
Przygotowanie
Podazotyn sodu ( trans ) jest konwencjonalnie wytwarzany przez redukcję azotynu sodu amalgamatem sodu .
- 2 NaNO 2 + 4 Na(Hg) + 2 H 2 O → Na 2 N 2 O 2 + 4 NaOH + 4 Hg
Podazotyn sodu ( trans ) został przygotowany w 1927 roku przez AW Scotta w reakcji azotynów alkilu , chlorku hydroksyloamoniowego i etanolanu sodu
- RONO + NH 2 OH + 2 EtONa → Na 2 N 2 O 2 + ROH + 2 EtOH
Wcześniejsza metoda, opublikowana przez D. Mendenhalla w 1974 r., polegała na reakcji gazowego tlenku azotu ( NO ) z metalicznym sodem w 1,2-dimetoksyetanie , toluenie i benzofenonie . Następnie sól ekstrahowano wodą. Metoda została później zmodyfikowana w celu użycia pirydyny [ potrzebne źródło ] .
Inne metody obejmowały utlenianie stężonego roztworu hydroksyloaminy azotynem sodu w środowisku alkalicznym [ potrzebne źródło ] ; lub elektroliza azotynu sodu.
Nawilża
Opisano różne hydraty Na2N2O2 ;
, gdzie H2O
,
4 , ( ) x izomeru trans ,
x obejmuje 2, 3,5 5 , 6 7, 8 i 9 ale jest jakiś spór.
Wydaje się, że woda hydratacyjna jest po prostu uwięziona w sieci krystalicznej, a nie skoordynowana z jonami. Substancję bezwodną można otrzymać susząc hydraty nad pięciotlenkiem fosforu , a następnie ogrzewając je do 120°C.
Reakcje
Podazotyn sodu ( trans ) w CO2
roztworze rozkłada się pod wpływem dwutlenku węgla z powietrza, tworząc węglan sodu .
Ciekły N 2 O 4 utlenia podazotyn sodu ( trans ) do nadtlenohiponitrynu sodu Na
2+ 2 [ON=NOO] 2− ).
izomer cis
Izomer cis podazotynu sodu jest białą krystaliczną substancją stałą, nierozpuszczalną w rozpuszczalnikach aprotonowych i (w przeciwieństwie do izomeru trans ) rozkładającą się pod wpływem wody i innych rozpuszczalników protonowych .
Przygotowanie
Izomer cis można otrzymać przepuszczając tlenek azotu ( NO ) przez roztwór metalicznego sodu w ciekłym amoniaku w temperaturze -50°C.
Izomer cis został również Na2O
otrzymany w 1996 tlenku N2O
. roku przez C. Feldmanna i M. Jansena przez ogrzewanie sodu z 77 kPa podtlenku azotu (gaz rozweselający) w zamkniętej probówce w temperaturze 360°C przez 2 godziny Dwa odczynniki połączyły się, dając ilościowo podazotyn cis w postaci białych mikrokryształów.
Właściwości i reakcje
Bezwodna sól cis jest stabilna do 325 ° C, kiedy jest nieproporcjonalna do azotu i ortoazotynu sodu:
- 3 Na
2 N
2 O
2 → 2 Na
3 O ( NO
2 ) + 2 N
2
Na ogół jest bardziej reaktywny niż izomer trans .