Ralstonia solanacearum
|
|
| Ralstonia solanacearum | |
|---|---|
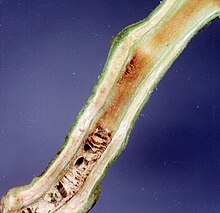
| Uszkodzenia powodowane przez Ralstonia solanacearum na łodydze pomidora | |
| Klasyfikacja naukowa | |
| Domena: | Bakteria |
| Gromada: | pseudomonadota |
| Klasa: | betaproteobakterie |
| Zamówienie: | Burkholderiales |
| Rodzina: | Burkholderiaceae |
| Rodzaj: | Ralstonia |
| Gatunek: |
R. solanacearum
|
| Nazwa dwumianowa | |
|
Ralstonia solanacearum ( Smith 1896) Yabuuchi i in. 1995 |
|
| Wpisz szczep | |
|
ATCC 11696 |
|
| Nazwy synonimowe | |
|
|
|
Ralstonia solanacearum jest tlenową , nietworzącą przetrwalników, Gram-ujemną bakterią chorobotwórczą dla roślin . R. solanacearum jest przenoszony przez glebę i ruchliwy z polarną kępką wici . Kolonizuje ksylem , powodując więdnięcie bakteryjne w bardzo szerokim zakresie potencjalnych roślin żywicielskich. Jest znany jako więdnięcie Granville'a , gdy występuje w tytoniu . Bakteryjne więdnięcie pomidora, papryki, bakłażana i irlandzkiego ziemniaka spowodowane przez R. solanacearum były jednymi z pierwszych chorób, które, jak udowodnił Erwin Frink Smith, były spowodowane przez patogen bakteryjny. Ze względu na swoją niszczycielską śmiertelność R. solanacearum jest obecnie jedną z intensywniej badanych fitopatogennych bakterii, a bakteryjne więdnięcie pomidora jest modelowym układem do badania mechanizmów patogenezy. Ralstonia była do niedawna klasyfikowana jako Pseudomonas , z podobieństwem w większości aspektów, z wyjątkiem tego, że nie wytwarza pigmentu fluorescencyjnego, takiego jak Pseudomonas . Genomy różnych szczepów wahają się od 5,5 Mb do 6 Mb, w przybliżeniu 3,5 Mb chromosomu i 2 Mb megaplazmidu. Podczas gdy szczep GMI1000 był jedną z pierwszych bakterii fitopatogennych, których genom został ukończony, szczep UY031 był pierwszym R. solanacearum , którego metylom został opisany. W obrębie R. solanacearum cztery główne monofiletyczne skupiska szczepów nazywane są filotypami , które są odrębne geograficznie: filotypy I-IV występują odpowiednio w Azji, obu Amerykach, Afryce i Oceanii.
Ralstonia solanacearum była kiedyś uważana za możliwy biologiczny środek zwalczania imbiru kahili ( Hedychium gardnerianum ), wysoce inwazyjnego gatunku. Jednak R. solanacearum nie jest już używany jako biologiczna kontrola imbiru Kahili w hawajskich lasach ze względu na szeroki zakres żywicieli. Pasożytniczy szczep imbiru zakaża wiele gatunków imbiru, w tym imbir jadalny ( Zingiber officinale ), imbir szamponowy ( Z. zerumbet ) oraz imbir różowy i czerwony ( Alpinia purpurata ).
Gospodarze i objawy
Zastępy niebieskie
Gospodarze roślinni zakażani przez R. solanacearum obejmują:
- Ziemniaka
- Uprawy ( Solanum tuberosum ); pomidor ( Lycopersicum esculentum ); soja ( Glycine max ); bakłażan /bakłażan ( Solanum melongena ); banan ( Musa spp); pelargonia ( Pelargonium spp.); imbir ( Zingiber officinale ); tytoń ( Nicotiana tabacum ); słodka papryka ( Capsicum spp.); oliwka ( Olea europea ); Róża ( Róża ). [ potrzebne źródło ]
- Dzicy gospodarze
- Wsianka psiankowata ( Solanum dulcamara )
Objawy
geranium :
- Więdnięcie zaczyna się od dolnych liści i ogonków liściowych i postępuje w górę rośliny.
- Zwiędłe liście mają chlorotyczne, klinowate obszary lub chlorotyczne i/lub nekrotyczne brzegi liści. Nie widać plam na liściach.
- Ostatecznie cała roślina zapada się na podłożu.
- Biała, płynna substancja sączy się z ciętych łodyg.
Ziemniak :
- Więdnięcie liści następuje pod koniec dnia z regeneracją w nocy. Rośliny ostatecznie nie regenerują się i umierają.
- Następuje brązowe zabarwienie pierścienia naczyniowego i ropa może sączyć się z pierścienia, gdy bulwa jest ściśnięta.
- Blady szlam może wydobywać się z oczu i końca ziemniaka. Gleba będzie przylegać do sączących oczu.
- Przekrój łodygi umieszczonej w wodzie będzie wydzielał mlecznobiałe pasma.
- W przeciwieństwie do więdnięcia grzybów, liście pozostają zielone w przypadku więdnięcia bakteryjnego.
Cykl chorobowy
Przetrwanie
Ralstonia solanacearum może zimować w szczątkach roślinnych lub chorych roślinach, dzikich żywicielach, nasionach lub wegetatywnych organach rozmnażania (innej plazmie zarodkowej ), takich jak bulwy. Bakterie mogą przetrwać w wodzie przez długi czas (do 40 lat w temperaturze 20–25 °C (68–77 °F) w czystej wodzie), a populacja bakterii zmniejsza się w ekstremalnych warunkach (temperatura, pH, sole, np. ). Zainfekowana ziemia czasami nie może być ponownie wykorzystana pod uprawy podatne przez kilka lat. R. solanacearum może również przetrwać w chłodne dni i wejść w stan, w którym jest zdolny do życia, ale nie nadaje się do hodowli. W większości przypadków ten etap nie stanowi zagrożenia dla rolnictwa, ponieważ bakterie zwykle stają się niezjadliwe po wyzdrowieniu.
Rozproszenie
Ralstonia solanacearum powoduje więdnięcie przy dużych populacjach (10 8 – 10 10 jtk /g tkanki) i rozprzestrzenia się kilkoma drogami. Duża liczba R. solanacearum może wydzielać się z korzeni roślin wykazujących objawy i nie wykazujących objawów. Poza tym szlam bakteryjny (który jest zwykle używany jako znak do wykrywania) na powierzchni roślin) może przedostać się do otaczającej gleby lub wody, zanieczyszczając sprzęt rolniczy lub może zostać nabyty przez owady-wektory. Ponadto patogen ten może być przenoszony przez zanieczyszczoną wodę powodziową, nawadnianie, zanieczyszczone narzędzia lub zainfekowane nasiona. W północnej Europie patogen zadomowił się w chwastach psiankowatych rosnących w wolno płynących rzekach. Kiedy tak zanieczyszczona woda jest używana do nawadniania ziemniaków, patogen dostaje się do systemu produkcji ziemniaków. Rasa 3 biovar 2 może przetrwać w wieloletnich psiankowatych, które działają jako żywiciele wtórni, a także może powodować bakteryjne więdnięcie pomidora. Niektórym państwom UE i krajom Bliskiego Wschodu nie udało się jeszcze wyeliminować tego patogenu. [ potrzebne źródło ]
Infekcja
Ralstonia solanacearum zwykle wnika do rośliny przez ranę. Miejscami wejścia R. solanacearum mogą stać się rany naturalne (powstałe w wyniku odcięcia kwiatów, powstania korzeni bocznych) i nienaturalne (poprzez praktyki rolnicze lub nicienie i owady żywiące się ksylemem) . Bakterie uzyskują dostęp do ran częściowo dzięki ruchliwości pływackiej za pośrednictwem wici i chemotaktycznemu do wysięków z korzeni. W przeciwieństwie do wielu bakterii fitopatogennych , R. solanacearum potencjalnie wymaga tylko jednego miejsca wejścia, aby wywołać infekcję ogólnoustrojową, która powoduje więdnięcie bakterii.
Po zaatakowaniu podatnego żywiciela R. solanacearum namnaża się i przemieszcza systemowo w obrębie rośliny, zanim pojawią się objawy więdnięcia bakteryjnego. Więdnięcie należy uznać za najbardziej widoczny efekt uboczny, który zwykle występuje po ekstensywnej kolonizacji patogenu. Kiedy patogen dostaje się do ksylemu przez naturalne otwory lub rany, tylozy , aby zablokować osiową migrację bakterii w roślinie. W podatnych roślinach czasami dzieje się to powoli i rzadko, aby zapobiec migracji patogenów, i zamiast tego może prowadzić do dysfunkcji naczyń poprzez niespecyficzne blokowanie nieskolonizowanych naczyń. [ potrzebne wyjaśnienie ]
Więdnięcie występuje przy dużej populacji bakterii w ksylemie i jest częściowo spowodowane dysfunkcją naczyń, w której wystarczająca ilość wody nie może dotrzeć do liści. W tym czasie pozakomórkowego polisacharydu (EPS1) wynosi około 10 μg/g tkanki w korzeniu palowym, hipokotylu i łodydze środkowej; Stężenie EPS1 jest wyższe później i wynosi ponad 100 μg/g tkanki w całkowicie zwiędłej roślinie. Ralstonia powoduje również utratę kontroli nad aparatami szparkowymi, ale żadne dowody nie wskazują na nadmierną transpirację jako jej konsekwencję. Głównym czynnikiem przyczyniającym się do więdnięcia jest prawdopodobnie blokowanie błon pestek w ogonkach i liściach przez EPS1 o wysokiej masie cząsteczkowej. Wysokie zagęszczenie bakterii jest produktem ubocznym degradacji ściany komórkowej roślin; tylozy i gumy wytwarzane przez samą roślinę to inne czynniki przyczyniające się do więdnięcia.
Naturalna transformacja genetyczna
Większość szczepów R. solanacearum jest kompetentna do transformacji genetycznej. Naturalna transformacja genetyczna jest procesem seksualnym obejmującym przeniesienie DNA z jednej komórki bakteryjnej do drugiej za pośrednictwem pośredniczącej pożywki oraz integrację sekwencji dawcy z genomem biorcy poprzez rekombinację homologiczną . R. solanacearum potrafi wymieniać duże fragmenty DNA w zakresie od 30 do 90 tysięcy zasad.
Mechanizmy wirulencji
Ralstonia solanacearum posiada geny dla wszystkich sześciu szlaków wydzielania białek, które zostały scharakteryzowane u bakterii Gram-ujemnych. Być może najlepiej zbadanym z nich jest system wydzielniczy typu III (T3SS lub TTSS), który wydziela promujące infekcję białka efektorowe (T3E) do komórek gospodarza. Do tej pory u R. solanacearum zidentyfikowano około 74 podejrzanych lub potwierdzonych T3E , chociaż funkcje bardzo niewielu są obecnie znane. Pomimo tego, że jest tylko jednym z kilku systemów wydzielania białek, T3SS jest niezbędny dla R. solanacearum spowodować chorobę. Stwierdzono, że żadne pojedyncze białko efektorowe nie zmienia znacząco patogeniczności R. solanacearum , ale równoczesne zaburzenie pewnych podzbiorów efektorów (takich jak zestaw siedmiu efektorów GALA w szczepie GMI1000) silnie wpływa na wirulencję patogenu. Na przykład GALA 7 jest niezbędna do zjadliwości na Medicago truncatula , co sugeruje, że różnorodność T3E może odgrywać rolę w określaniu szerokiego zakresu żywicieli kompleksu gatunków R. solanacearum .
System wydzielniczy typu III nie jest unikalny dla R. solanacearum i jest w rzeczywistości bardzo stary. Ewolucyjna historia T3SS jest kwestionowana; wysoki stopień podobieństwa do wici wywołał debatę na temat związku między tymi dwiema strukturami.
Środowisko
Środowisko, w którym powszechnie występuje R. solanacearum , zależy od konkretnej rasy (zróżnicowana genetycznie populacja w obrębie gatunku) oraz konkretnego biovaru (szczep, który różni się fizjologicznie lub biochemicznie od innych szczepów). Rasa 1, rasa 2 biovar 1 i rasa 3, biovar 2 to trzy najpowszechniejsze i najważniejsze szczepy. Szczepy rasy 1 mają szeroki zakres żywicieli, w tym tytoń i banany, i zwykle występują w środowiskach tropikalnych i subtropikalnych, ponieważ mają problemy z przetrwaniem w niższych temperaturach i są endemiczne dla południowo-wschodnich Stanów Zjednoczonych. Szczepy rasy 2 mają bardziej ograniczony zakres żywicieli niż rasa 1 i są głównie ograniczone do środowisk tropikalnych. Odmiany rasy 3 są bardziej odporne na zimno niż pozostałe dwa i występują na tropikalnych wyżynach i obszarach o klimacie umiarkowanym. Zakres roślin żywicielskich dla rasy 3 biovar 2 obejmuje ziemniaki, pomidory i pelargonie. Rasa 3 biovar 2 jest bardzo powszechna na całym świecie, ale generalnie nie jest zgłaszana w Ameryce Północnej, dlatego jest przedmiotem wielu praktyk zarządzania sanitacją i kwarantanną, aby zapobiec wprowadzeniu lub rozprzestrzenianiu się patogenu.
Chociaż jeszcze go nie ma, naukowcy z University of Guam są zaniepokojeni możliwym rozprzestrzenieniem się R. solanacearum na Guam .
Kierownictwo
Ogólne zarządzanie
Komercyjne chemikalia ogólnie okazały się nieskuteczne w zwalczaniu patogenu i nie są zalecane jako środek kontroli. W regionach, w których patogen się zadomowił, strategia zintegrowanego zarządzania chorobą jest najlepszą metodą ograniczenia wpływu patogenu. Stosowanie materiałów do sadzenia wolnych od patogenów jest koniecznością. Sadzenie odmian odpornych minimalizuje złe skutki patogenu, chociaż obecnie nie są dostępne odmiany całkowicie odporne. Wreszcie, dobry system płodozmianu, który następuje po uprawach podatnych z uprawami odpornymi lub niebędącymi żywicielami, może pomóc w zmniejszeniu patogenu. Patogen jest wymieniony jako wybrany czynnik w Stanach Zjednoczonych; jeśli patogen zostanie wykryty przez odpowiednie władze, można wdrożyć szereg protokołów zarządzania. Mogą one obejmować zarówno ankiety, jak i kwarantanny zainfekowanego i potencjalnie zainfekowanego materiału roślinnego, co z kolei może prowadzić do zakrojonych na szerszą skalę programów zwalczania i sanitacji.
Specyficzne objawy i zarządzanie roślinami żywicielskimi
Ziemniak
Typowymi objawami są więdnięcie i żółknięcie liści, a także ogólne zahamowanie wzrostu rośliny. Liście mogą również przybrać brązowy odcień, a łodygi stają się smugi, a oczka bulw stają się odbarwione. Bulwy również zaczynają gnić, jeśli zostaną pozostawione w ziemi. Mlecznobiały lepki wysięk lub szlam, składający się z komórek bakteryjnych i ich pozakomórkowego polisacharydu, jest zwykle zauważalny na świeżo pociętych skrawkach porażonych bulw. Zwalczanie R. solanacearum jest trudne, ponieważ jest to patogen przenoszony przez glebę, ma szeroki zakres żywicieli, długie przeżycie w glebie i duże zróżnicowanie biologiczne. Żadna pojedyncza metoda zwalczania nie okazała się w 100% skuteczna, chociaż w miejscach, w których patogen się zadomowił, możliwy był pewien poziom kontroli więdnięcia bakterii dzięki zastosowaniu kombinacji różnych metod. Metody te obejmują fitosanitację i praktyki hodowlane, kontrolę chemiczną, kontrolę biologiczną i odporność żywiciela. Zaleca się ogólne praktyki sanitarne, aby zapobiec rozprzestrzenianiu się choroby, ponieważ kontrola chemiczna jest nieskuteczna. płodozmian z uprawami odpornymi, podobnie jak zmiana pH gleby, aby utrzymać ją na niskim poziomie latem (4-5), a wyższym jesienią (6).
Pomidor
Młodsze liście rośliny staną się wiotkie, a na łodydze rośliny mogą pojawić się korzenie przybyszowe. Układ naczyniowy wykazuje stopniowo ciemniejszy brązowy kolor w miarę postępu choroby, oprócz możliwych zmian na łodydze. Praktyki zarządzania są podobne do praktyk ziemniaka. [ potrzebne źródło ]
Banan
Powszechnie znana jako choroba Moko, od odmiany bananów z Trynidadu , która wymarła w latach 90. XIX wieku. Zazwyczaj występuje żółknięcie i więdnięcie starszych liści, a także zmniejszenie wielkości owoców i ewentualne gnicie owoców. Ponadto kwiaty mogą stać się poczerniałe i pomarszczone, a tkanka naczyniowa może ulec odbarwieniu. Jedynym skutecznym sposobem zwalczania jest wykluczenie choroby tam, gdzie jej nie ma. Jeśli obszar zostanie zainfekowany, wszystkie zainfekowane rośliny muszą zostać wyeliminowane, dlatego należy stosować rygorystyczne praktyki sanitarne, aby ograniczyć rozprzestrzenianie się choroby.
Znaczenie
Ralstonia solanacearum jest klasyfikowana jako jedna z najważniejszych bakterii fitopatogennych na świecie ze względu na swoją śmiertelność, trwałość, szeroki zakres żywicieli i szerokie rozmieszczenie geograficzne. Chociaż patogen powoduje znaczne straty w plonach w tropikach i subtropikach, obecnie stanowi ciągłe zagrożenie w klimacie umiarkowanym.
Ralstonia solanacearum jest znanym obcym patogenem roślin o statusie kwarantanny A2, atakującym bardzo szeroki zakres upraw. Oznacza to, że występuje w niektórych częściach Europy, ale podlega ustawowej kontroli. Na całym świecie najważniejsze uprawy dotknięte chorobą to: ziemniaki, pomidory, tytoń, banany i geranium. W Wielkiej Brytanii i pozostałych krajach UE najważniejszymi uprawami, których to dotyczy, są ziemniaki i pomidory. Spowodowałoby to poważne szkody gospodarcze, gdyby stało się bardziej ugruntowane niż obecnie. Straty wynikają z rzeczywistego zmniejszenia plonów, a także z powodu ustawowych działań podjętych w celu wyeliminowania choroby. [ potrzebne źródło ]
Więdnięcie bakteryjne powodowane przez R. solanacearum ma znaczenie gospodarcze, ponieważ poraża ponad 250 gatunków roślin w ponad 50 rodzinach. Od 2007 roku patogen ten dotknął ponad 450 gatunków żywicieli reprezentujących 54 rodziny roślin ze względu na szeroki zakres żywicieli na całym świecie. Choroba jest znana jako więdnięcie południowe, więdnięcie bakteryjne i brązowa zgnilizna ziemniaka. o wiele więcej roślin dwuliściennych niż jednoliściennych . Wśród żywicieli jednoliściennych dominuje rząd Zingiberales, z pięcioma z dziewięciu rodzin zakażonych tą bakterią. Powód, dla którego niektóre rodziny są bardziej podatne na więdnięcie bakteryjne, jest nadal nieznany. Pierwotnie R. solanacearum występuje w klimacie tropikalnym, subtropikalnym i ciepłym, umiarkowanym, ale uważa się, że nie przeżywa niskich temperatur. Jednak ten patogen został niedawno wykryty w pelargonii ( Pelargonium spp.) w stanie Wisconsin w USA i został prześledzony wstecz do importu sadzonek pelargonii do Ameryki Północnej i Europy z górzystych tropików, gdzie rasa 3 bioodmiana 2 jest endemiczna
Brązowa zgnilizna ziemniaka powodowana przez R. solanacearum rasa 3 biowar 2 jest jedną z najpoważniejszych chorób ziemniaka na świecie i odpowiada za straty szacowane na 950 milionów dolarów rocznie. Rasa 3 biovar 2 jest tolerancyjna na zimno i sklasyfikowana jako patogen kwarantannowy. Ponadto ta rasa / biowar została wymieniona jako wybrany środek w ustawie o bioterroryzmie rolniczym z 2002 r. I uważa się, że ma potencjał do wykorzystania jako broń bioterrorystyczna .
Zobacz też
- Poueymiro, M.; Genin, S. (2009). „Sekretne białka z Ralstonia solanacearum : sto sztuczek, aby zabić roślinę”. Aktualna opinia w mikrobiologii . 12 (1): 44–52. doi : 10.1016/j.mib.2008.11.008 . PMID 19144559 .
Linki zewnętrzne
- Profil gatunku — południowa więdnięcie bakteryjne ( Ralstonia solanacearum ) , Narodowe Centrum Informacji o Gatunkach Inwazyjnych, Narodowa Biblioteka Rolnicza Stanów Zjednoczonych . Zawiera ogólne informacje i zasoby dotyczące południowego więdnięcia bakteryjnego.
- Lista patogenów roślin podlegających kontroli eksportu
- Rodzaj szczepu Ralstonia solanacearum w Bac Dive - the Bacterial Diversity Metadatabaza
- Moorman, Gary W. (kwiecień 2011). "Więdnięcie bakteryjne - Ralston solanacearum " . Rozszerzenie PennState .

