Siglec
| Identyfikatory | |
|---|---|
| rodziny lektyn Ig-podobnych wiążące kwas sialowy | |
| Symbol | SIGLEC |
| Błona | 210 |
Siglecs (lektyny typu immunoglobuliny wiążące kwas sialowy) to białka powierzchniowe komórki , które wiążą kwas sialowy . Występują głównie na powierzchni komórek odpornościowych i są podzbiorem lektyn typu I. Istnieje 14 różnych ssaków Siglec, zapewniających szereg różnych funkcji w oparciu o interakcje receptor-ligand na powierzchni komórki.
Historia
Pierwszym opisanym kandydatem Siglec była Sialoadhesin (Siglec-1/CD169), podobne do lektyny białko adhezyjne na makrofagach . Równoległe badania przeprowadzone przez Ajita Varki i współpracowników na wcześniej sklonowanym CD22 ( białku powierzchniowym komórek B zaangażowanym w adhezję i aktywację) wykazały bezpośredni dowód na rozpoznawanie kwasu sialowego. Późniejsze klonowanie Sialoadhesin przez Crockera ujawniło homologię do CD22 (Siglec-2), CD33 (Siglec-3) i glikoproteiny związanej z mieliną (MAG/Siglec-4), co prowadzi do propozycji rodziny „Sialoadhesins”. Następnie Varki zasugerował termin Siglec jako lepszą alternatywę i jako podzbiór lektyn typu I (typu Ig) . Ta nomenklatura została uzgodniona i została przyjęta przez prawie wszystkich badaczy pracujących nad tymi cząsteczkami (zgodnie z konwencją, Siglecs są zawsze pisane wielką literą). U ludzi zidentyfikowano kilka dodatkowych Siglecs (Siglecs 5-12), które są bardzo podobne w strukturze do CD33 i dlatego są zbiorczo określane jako „Siglecs związane z CD33”. Zidentyfikowano dalsze Siglecy, w tym Siglec-14 i Siglec-15. Siglecs scharakteryzowano na dwie odrębne grupy: pierwszą i wysoce konserwatywną grupę ssaków złożoną z Sialoadhesins, CD22, MAG i Siglec-15 oraz drugą grupę obejmującą Siglecs blisko spokrewniony z CD33. Inne takie jak Siglec-8 i Siglec-9 mają homologi u myszy i szczurów (odpowiednio Siglec-F i Siglec-E u obu). Ludzie mają większą liczbę Sigleców niż myszy, więc system numeracji został oparty na ludzkich białkach.
Struktura
białka transbłonowe typu I , w których cytozolowy koniec NH3 + znajduje się w koniec COO- przestrzeni zewnątrzkomórkowej , a jest . Każdy Siglec zawiera N-końcową domenę immunoglobuliny typu V (domena Ig), która działa jako receptor wiążący dla kwasu sialowego. Lektyny te zalicza się do grupy lektyn typu I, ponieważ domeną lektynową jest fałd immunoglobulinowy. Wszystkie Siglecs są wydłużone z powierzchni komórki przez domeny Ig typu C2, które nie mają aktywności wiążącej. Siglecs różnią się liczbą tych domen typu C2. Ponieważ te białka zawierają domeny Ig, są członkami Nadrodzina immunoglobulin (IgSF).
Większość Sigleców, takich jak CD22 i rodzina spokrewniona z CD33, zawiera ITIM ( motywy hamujące oparte na immunoreceptorze tyrozyny ) w swoim regionie cytozolowym. Działają one w celu zmniejszenia szlaków sygnałowych obejmujących fosforylację , takich jak te indukowane przez ITAM ( motywy aktywacyjne oparte na immunoreceptorze tyrozyny ). Niektóre jednak, jak Siglec-14, zawierają dodatnie reszty aminokwasowe, które pomagają dokować białka adaptorowe zawierające ITAM, takie jak DAP12.
Wiązanie liganda
Ze względu na kwaśny charakter kwasu sialowego, miejsca aktywne Siglec zawierają konserwowaną resztę argininy , która jest naładowana dodatnio w fizjologicznym pH . Aminokwas ten tworzy mostki solne z grupą karboksylową reszty cukrowej. Najlepiej widać to w Sialoadhesin, gdzie arginina w pozycji 97 tworzy mostki solne z grupą COO- kwasu sialowego, tworząc stabilną interakcję. Każda domena lektyny jest specyficzna dla wiązania, które łączy kwas sialowy z glikanem . Kwas sialowy zawiera liczne hydroksylowe , które mogą brać udział w tworzeniu wiązań glikozydowych , które obserwuje się przy atomach węgla nr 2, 3, 6 i 8 szkieletu cukrowego. Specyficzność wiązania każdego Siglec wynika z różnych interakcji chemicznych między ligandem cukrowym a aminokwasami Siglec. Pozycja w przestrzeni poszczególnych grup na cukrze i aminokwasach białkowych wpływa na wiązanie kwasu sialowego, z którym wiąże się każdy Siglec. Na przykład Sialoadhesin preferencyjnie wiąże wiązania α2,3 zamiast wiązań α2,6.
Funkcjonować
Podstawową funkcją Siglecs jest wiązanie glikanów zawierających kwasy sialowe. Te interakcje receptor-glikan mogą być wykorzystywane w adhezji komórek, sygnalizacji komórkowej i innych. Funkcja Siglecs jest ograniczona do ich rozmieszczenia w komórkach. Na przykład MAG znajduje się tylko na oligodendrocytach i komórkach Schwanna , podczas gdy Sialoadhesin jest zlokalizowana na makrofagach.
Większość Sigleców jest krótkich i nie wystaje daleko od powierzchni komórki. Zapobiega to wiązaniu się większości Sigleców z innymi komórkami, ponieważ komórki ssaków są pokryte glikanami zawierającymi kwas sialowy. Oznacza to, że większość Sigleców wiąże ligandy tylko na powierzchni tej samej komórki, tak zwane cis , ponieważ są one „zalewane” przez glikany na tej samej komórce. Jedynym wyjątkiem jest Sialoadhesin, która zawiera 16 domen C2-Ig, wytwarzając długie, wydłużone białko, umożliwiające wiązanie trans -ligandów, tj. ligandów znajdujących się na innych komórkach. Wykazano, że inne, takie jak MAG, również wiążą trans -ligandy.
Sygnalizacja
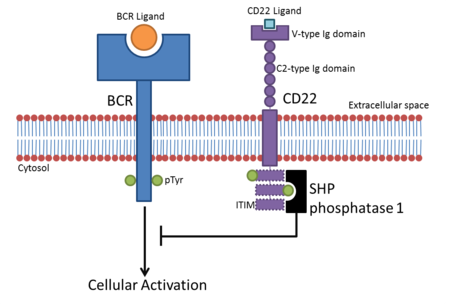
Członkowie rodziny siglec to sparowane receptory o przeciwstawnych wewnątrzkomórkowych funkcjach sygnalizacyjnych. Ze względu na regiony cytoplazmatyczne zawierające ITIM, większość Sigleców zakłóca sygnalizację komórkową, hamując aktywację komórek odpornościowych. Po związaniu się z ligandami Siglecs rekrutują białka hamujące, takie jak fosfatazy SHP, poprzez swoje domeny ITIM. Tyrozyna zawarta w ITIM jest fosforylowana po związaniu liganda i działa jako miejsce dokowania dla domenę SH2 , takich jak fosfatazy SHP. Prowadzi to do defosforylacji białek komórkowych, regulując w dół aktywujące szlaki sygnałowe.
Przykłady negatywnej sygnalizacji:
- CD22 znajduje się na komórkach B. Komórki B stają się aktywne, gdy receptor komórek B (BCR) wiąże się ze swoim pokrewnym ligandem. Gdy BCR jest związany ze swoim ligandem, receptor autofosforyluje swój region cytoplazmatyczny (ogień cytoplazmatyczny). Prowadzi to do fosforylacji trzech ITIM w cytoplazmatycznym ogonie CD22, co prowadzi do rekrutacji SHP-1 , który negatywnie reguluje aktywację komórkową opartą na BCR. Tworzy to próg aktywacji dla aktywacji komórek B, przez co zapobiega się przejściowej aktywacji komórek B. Pierwotnie uważano, że hamowanie sygnalizacji BCR przez CD22 jest niezależne od wiązania kwasu sialowego, ale dowody sugerują, że do hamowania wymagane są ligandy kwasu sialowego α2,6.
- Siglec-7 znajduje się na komórkach Natural Killer (komórki NK). Siglec-7 prowadzi do inaktywacji komórkowej po związaniu z pokrewnym ligandem zawierającym kwas sialowy i występuje w dużych ilościach na powierzchni komórek NK. Jest stosowany w kontaktach komórka-komórka, wiążąc się z sialowanymi glikanami na komórkach docelowych, co prowadzi do zahamowania zależnego od komórek NK zabijania komórki docelowej. Komórki ssaków zawierają wysokie poziomy kwasu sialowego, więc kiedy komórki NK wiążą tak zwane „własne komórki”, nie są aktywowane i nie zabijają komórek gospodarza.
Siglec-14 zawiera resztę argininy w swoim regionie przezbłonowym. To wiąże się z białkami DAP10 i DAP12 zawierającymi ITAM. Po związaniu ze swoim ligandem Siglec-14 prowadzi do aktywacji komórkowych szlaków sygnałowych poprzez białka DAP10 i DAP12. Białka te regulują w górę kaskady fosforylacji z udziałem wielu białek komórkowych, co prowadzi do aktywacji komórkowej. Wydaje się, że Siglec-14 kolokalizuje się z Siglec-5, a ponieważ to białko hamuje komórkowe szlaki sygnałowe, koordynuje przeciwstawne funkcje w komórkach odpornościowych.
Fagocytoza i adhezja
Siglecs, które mogą wiązać trans -ligandy, takie jak Sialoadhesin, umożliwiają interakcje komórka-komórka. Te interakcje glikan-Siglec umożliwiają komórkom wiązanie się ze sobą, umożliwiając w niektórych przypadkach sygnalizację lub, w przypadku Sialoadhesin, wychwyt patogenu . Pierwotnie uważano, że funkcja Sialoadhesin jest ważna w wiązaniu z krwinkami czerwonymi . Sialoadhesin nie ma cytozolowego ITIM ani reszty dodatniej do wiązania adapterów zawierających ITAM, dlatego uważa się, że nie wpływa na sygnalizację. Badania pokazują, że białko to bierze udział w fagocytozie bakterii, które zawierają wysoce sjalowane struktury glikanów, takie jak lipopolisacharyd z Neisseria meningitidis . Wiązanie się z tymi strukturami umożliwia makrofagom fagocytozę tych bakterii, oczyszczając system z patogenów.
Siglec-7 jest również stosowany do wiązania patogenów, takich jak Campylobacter jejuni . Dzieje się to w sposób zależny od kwasu sialowego i powoduje kontakt komórek NK i monocytów , na których zachodzi ekspresja Siglec-7, z tymi bakteriami. Komórka NK jest wtedy w stanie zabić te obce patogeny.
Studia odwykowe
nokautowe są często wykorzystywane do odkrycia funkcji białek w komórce. Myszy są często wykorzystywane, ponieważ wyrażają nasze ortologiczne białka lub bardzo podobne homologi.
Oto kilka przykładów nokautujących Sigleców:
- mutantami z nokautem i delecją CD22 , aby rozpoznać funkcję CD22. Te zmutowane komórki B nie wywnioskowały o żadnej chorobie autoimmunologicznej , ale zaobserwowały zwiększoną produkcję autoprzeciwciał z powodu braku hamowania sygnalizacji BCR, zwykle prowadzonej przez CD22. Autoprzeciwciała są specyficzne dla własnych białek i mogą prowadzić do uszkodzenia gospodarza. CD22 jest normalnie regulowany w górę przez wiązanie lipopolisacharydu z receptorami Toll-podobnymi . Zmutowane komórki B nie mogą regulować w górę zmutowanego białka i dlatego stają się nadwrażliwe w obecności lipopolisacharydu. Oznacza to, że limfocyty B wytwarzają nadprodukcję przeciwciał, podczas gdy normalnie przeciwciała nie zostałyby wyprodukowane.
- MAG (glikoproteina związana z mieliną) ulega ekspresji na komórkach tworzących osłonki mielinowe (komórki Schwanna i oligodendrocyty) wokół neuronów . MAG wiąże się z sialilowanymi ligandami na neuronie. Wyeliminowanie MAG w obwodowym układzie nerwowym prowadzi do zmniejszenia mielinizacji neuronów. Wybicie MAG w ośrodkowym układzie nerwowym myszy nie wydaje się wpływać na mielinizację, ale interakcja między mieliną a neuronem pogarsza się wraz z wiekiem. Prowadzi to do defektów neurologicznych, ponieważ potencjał czynnościowy nie może przechodzić tak szybko wzdłuż aksonu podczas stymulacji nerwowej. Usunięcie ligandu dla MAG poprzez wybicie genu transferazy GalNAc wymaganego do tworzenia ligandu ma podobne skutki jak u myszy z nokautem MAG
Sigleki ludzi/naczelnych
| Nazwa | Dystrybucja komórkowa | Specyficzność wiązania kwasu sialowego | Liczba domen C2-Ig | ITIM lub pozostałość dodatnia |
|---|---|---|---|---|
| Siglec-1 ( Sialoadhesin ) | makrofagi | α2,3>α2,6 | 16 | Nic |
| Siglec-2 ( CD22 ) | Komórki B | α2,6 | 6 | ITIM |
| Siglec-3 ( CD33 ) | Progenitory mieloidalne, monocyty | α2,6>α2,3 | 1 | ITIM |
| Siglec-4 ( MAG ) | Mielina | α2,3>α2,6 | 4 | Nic |
| Siglec-5 ( CD170 ) | Neutrofile, Monocyty | α2,3 | 3 | ITIM |
| Siglec-6 ( CD327 ) | Trofoblasty, komórki tuczne | α2,6 | 2 | ITIM |
| Siglec-7 ( CD328 ) | komórki NK | α2,8>α2,6>α2,3 | 2 | ITIM |
| Siglec-8 | Eozynofile, komórki tuczne | α2,3>α2,6 | 2 | ITIM |
| Siglec-9 ( CD329 ) | Monocyty, neutrofile, komórki dendrytyczne | α2,3=α2,6 (preferuje reszty siarczanowe) | 2 | ITIM |
| Siglec-10 | Komórki B | α2,3=α2,6 | 4 | ITIM |
| Siglec-11 | Komórki B | α2,8 | 4 | ITIM |
| Siglec-12 | makrofagi | Bez wiązania | 2 | ITIM |
| Siglec-13 | Monocyty szympansa | |||
| Siglec-14 | Nieznany | α2,6 | 2 | Arginina |
| Siglec-15 | Osteoklasty, makrofagi, DC | α2,6 | 1 | Lizyna |
| Siglec-16 | Makrofagi tkankowe | |||
| Siglec-17 | komórki NK |
Ta tabela krótko podsumowuje rozmieszczenie komórkowe każdego człowieka / naczelnego Siglec; specyficzność wiązania każdego z nich dla wiązania kwasu sialowego; liczbę zawartych w nim domen C2-Ig; oraz czy zawiera ITIM lub dodatnią resztę wiążącą białka adaptorowe zawierające ITAM. Odniesienia w nagłówkach kolumn odpowiadają wszystkim informacjom wyświetlanym w tej kolumnie, chyba że pokazano inne odniesienia. Informacje Siglec-12 są przywoływane tylko przez, z wyłączeniem specyficzności powiązań.
Mimetyki
Wiele patologii powiązano ze spontanicznymi interakcjami między kwasem sialowym a immunosupresyjnymi receptorami lektynowymi (Siglec) wiążącymi kwas sialowy na komórkach odpornościowych, takich jak rak, HIV- 1 i zakażenie paciorkowcami grupy B. Rodzina kwasu sialowego odgałęzia się od glikanów, łańcuchów cukrowych zawierających różne monosacharydy, które pokrywają błonę każdej żywej komórki i wykazują oszałamiającą różnorodność strukturalną. Kwasy sialowe działają w fałdowaniu białek, rozwoju neuronów, interakcjach komórkowych i wielu innych procesach fizjologicznych. Ponieważ kwasy sialowe są obficie eksprymowane u kręgowców, a nie w mikroorganizmach, uważa się je za antygeny własne lub struktury własne, które odgrywają główną rolę w hamowaniu szkodliwej aktywności układu odpornościowego poprzez regulację neutrofile i tolerancja limfocytów B.
W układzie odpornościowym Siglecs, zwłaszcza te związane z CD33, kwasem sialowym i patogenami wiążącymi Siglec, podlegają zjawisku niekontrolowanej koewolucji Czerwonej Królowej poprzez presję selekcyjną, która utrzymuje zdolność wrodzonego układu odpornościowego do samorozpoznania i zapewnia zapobieganie autoimmunizacji choroby. Ten ewolucyjny łańcuch i nieustanne mutacje sprawiły, że Siglecs stał się jednym z najszybciej ewoluujących genów, o czym świadczą różnice wewnątrz- i międzygatunkowe. Polimorfizm unikalnych dla człowieka Siglec-12, -14 i -16 sugeruje, że trwa presja selekcyjna.
Ponieważ Siglecs charakteryzują się wyraźnymi preferencjami wiązania kwasu sialowego i jego modyfikacji, podjęto kilka prób chemicznej modyfikacji ligandów naturalnego kwasu sialowego, co ostatecznie doprowadziło do stworzenia mimetyków kwasu sialowego ( SAM) o zwiększonej zdolności wiązania i selektywności w stosunku do Siglecs.
Synteza
SAM można stosować do celowania w Siglec i modulowania komórek wyrażających Siglec poprzez modyfikację szkieletu kwasu sialowego w różnych pozycjach, od C-2 do C-9. Kwas karboksylowy należy jednak pozostawić w stanie nienaruszonym. Podjęto pierwsze próby opracowania mimetyków kwasu sialowego o wysokim powinowactwie do Siglec-2, co doprowadziło do odkrycia, że zwiększone powinowactwo wiązania pochodzi z wiązań wodorowych i interakcji lipofilowych między SAM i Siglec-2. Dokonano kilku oddzielnych modyfikacji w pozycjach C-2, C-5 i C-9, prowadząc Mescha i in. do postawienia hipotezy, że jednoczesna modyfikacja we wszystkich trzech pozycjach może prowadzić do optymalizacji wiązania.
Sukces w drastycznie wzmocnionym wiązaniu SAM z Siglec 2 sugeruje, że podobne podejście może działać na innych członkach rodziny. Niektóre modyfikacje obejmowały dodatkową jednoczesną modyfikację w pozycji C-4 szkieletu kwasu sialowego. Rozwój (miedzi) I-katalizowanej azydkowej cykloaddycji alkinowej ( CuAAC ) click chemii przyspieszył identyfikację nowych SAM i pozwolił na stworzenie nowych SAM o wysokim wiązaniu z Siglec-3, -5, -6, -7 i - 10. Od 2017 r. Zgłoszono SAM dla większości Siglec, z wyjątkiem Siglec -6, -8, -11, -14, -15 i -16.
Klastrowanie receptorów i wiązanie o wysokiej awidności, zwane łącznie wiązaniem wielowartościowym , może zwiększyć skuteczność SAM w organizmie człowieka. Obecnie postęp w glikoinżynierii wykorzystuje nanocząsteczki dekorowane SAM, polimery dekorowane SAM i syntezę SAM na komórkach, aby prezentować SAM Siglecs. Wykazano również, że liposomy usieciowane SAM pomagają w prezentacji antygenów komórkom prezentującym antygen poprzez szlaki Siglec-1 lub -7. Co więcej, komórki ludzkie, zmodyfikowane za pomocą kwasów sialowych zawierających Ac 5 NeuNPoc włączonych do sialoglikanów i azydku 3-bromo-benzylu, wykazywały nadaktywność wobec Siglec-2.
Linki zewnętrzne
- Functional Glycomics Gateway , współpraca między Consortium for Functional Glycomics i Nature Publishing Group
- Lektyny typu I (Siglecs) Badania przeprowadzone w Imperial College London dostarczają kolejnego przeglądu lektyn typu I