Zaurategrast
 | |
| Dane kliniczne | |
|---|---|
| Inne nazwy | CDP323 |
| Status prawny | |
| Status prawny |
|
| Identyfikatory | |
| |
| Numer CAS | |
| Identyfikator klienta PubChem | |
| ChemSpider | |
| UNII | |
| Pulpit nawigacyjny CompTox ( EPA ) | |
| Karta informacyjna ECHA | 100.158.922 |
| Dane chemiczne i fizyczne | |
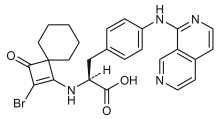
| Formuła | C26H25BrN4O3 _ _ _ _ _ _ _ _ |
| Masa cząsteczkowa | 521,415 g·mol -1 |
| Model 3D ( JSmol ) | |
| |
| |
Zauryrategrast ( CDP323 ) jest małocząsteczkowym prolekiem , antagonistą cząsteczki adhezyjnej komórek naczyniowych 1 (VCAM-1) wiążącej się z integrynami α4 . Pierwotnie został opracowany przez brytyjską firmę biofarmaceutyczną Celltech plc. (obecnie UCB SA ) i był przypuszczalnie nowym lekiem do doustnego leczenia stwardnienia rozsianego .
W październiku 2006 roku UCB i Biogen Idec ogłosiły współpracę w celu wspólnego opracowania i komercjalizacji zaurytegrastu do leczenia stwardnienia rozsianego i innych potencjalnych wskazań . W czerwcu 2009 r. zaprzestano opracowywania zauryrategrastu z powodu zniechęcających wyników badania klinicznego fazy II .
Mechanizm akcji
Uważano , że mechanizm działania zaurytegrastu polega na zapobieganiu migracji komórek odpornościowych z naczyń krwionośnych przez ściany naczyń do różnych tkanek objętych stanem zapalnym , w tym do mózgu . Uważa się, że ten mechanizm zapobiega nadmiernym reakcjom immunologicznym i następującym po nich uszkodzeniom tkanek, co widać podczas niekontrolowanej migracji komórek odpornościowych, jak w stwardnieniu rozsianym. Zaurategrast ma taki sam mechanizm działania jak przeciwciało monoklonalne natalizumab .
Wyniki w modelach zwierzęcych
Zauryrategrast badano w przewlekłym eksperymentalnym autoimmunologicznym zapaleniu mózgu i rdzenia (EAE) u myszy . Lek był skuteczny, gdy był podawany profilaktycznie (tj. przed wywołaniem choroby u myszy) i terapeutycznie (tj. po wybuchu choroby) i znacznie zmniejszał ciężkość choroby.
Rozwój kliniczny
Bezpieczeństwo, tolerancję i profil farmakokinetyczny zauryrategrastu oceniono u 75 zdrowych ochotników płci żeńskiej i męskiej w trzech oddzielnych badaniach fazy 1. Zauryrategrast był dobrze tolerowany w dawkach doustnych do 1000 mg podawanych dwa razy na dobę przez 7 kolejnych dni , a profil zdarzeń niepożądanych był porównywalny do obserwowanego w przypadku placebo . Nie było efektu płci. Podawanie doustne powodowało zahamowanie wiązania VCAM-1, które można było utrzymać przez 12- lub 24-godzinną przerwę między kolejnymi dawkami w dobrze tolerowanych dawkach
Badanie Fazy 2 rozpoczęło się w czerwcu 2007 roku w Europie i Stanach Zjednoczonych . Badanie ma na celu włączenie ponad 200 pacjentów z nawracającym SM, u których wcześniejsze leczenie interferonem -beta zakończyło się niepowodzeniem , i porównanie dwóch dawek leku z placebo w okresie sześciu miesięcy. Wyniki spodziewane są do końca 2008 r. Wstępna tymczasowa analiza skuteczności wykazała, że po sześciomiesięcznym okresie leczenia pacjenci włączeni do tego badania klinicznego nie odnieśli oczekiwanych korzyści z zauryrategrastu w porównaniu z placebo. Nie odnotowano przypadków postępującej wieloogniskowej leukoencefalopatii.