hipoglicyna A

|
|
| Nazwy | |
|---|---|
|
Preferowana nazwa IUPAC
(2S ) -2-amino-3-[(1R ) -2-metylidenecyklopropylo]propanowy |
|
| Inne nazwy hipoglicyna A; hipoglicyna; 2-Metylenocyklopropanyloalanina
|
|
| Identyfikatory | |
|
Model 3D ( JSmol )
|
|
| CHEMBL | |
| ChemSpider | |
| Karta informacyjna ECHA | 100.189.936 |
|
Identyfikator klienta PubChem
|
|
| UNII | |
|
Pulpit nawigacyjny CompTox ( EPA )
|
|
|
|
|
|
| Nieruchomości | |
| C7H11NO2 _ _ _ _ _ _ | |
| Masa cząsteczkowa | 141,170 g·mol -1 |
| Temperatura topnienia | 282 ° C (540 ° F; 555 K) |
|
O ile nie zaznaczono inaczej, dane podano dla materiałów w stanie normalnym (przy 25°C [77°F], 100 kPa).
|
|
Hipoglycyna A jest naturalnie występującą pochodną aminokwasu występującą w niedojrzałych owocach drzewa Ackee ( Blighia sapida ) oraz w nasionach drzewa bukszpanu ( Acer negundo ). Jest toksyczny w przypadku połknięcia i jest czynnikiem sprawczym jamajskiej choroby wymiotnej . W raporcie Lancet z 2017 r. ustalono związek między spożyciem niedojrzałych owoców liczi (zawierających hipoglicynę A lub metylenocyklopropyloglicynę (MCPG)) prowadzącym do hipoglikemii i śmierci z powodu ostrej toksycznej encefalopatii.
Źródła
Całość niedojrzałych owoców Ackee jest toksyczna i zawiera duże ilości hipoglicyny. Owoce można bezpiecznie jeść tylko wtedy, gdy owoc może się całkowicie otworzyć i odsłonić duże czarne nasiona na drzewie. Poziomy toksyny zmniejszają się z czasem od około 1000 ppm do około 0,1 ppm w dojrzałych owocach.
Spokrewnione Ackee, w tym liczi , longan i rambutan , mogą zawierać w swoich owocach wystarczającą ilość α-(metylenocyklopropylo)glicyny, homologu hipoglicyny A, aby spowodować encefalopatię hipoglikemiczną u niedożywionych dzieci, gdy są spożywane w dużych ilościach.
Toksyczność
Hipoglicyna A jest protoksyną , co oznacza, że cząsteczka sama w sobie nie jest toksyczna, ale po spożyciu rozkłada się na toksyczne produkty. Kompleks dehydrogenazy alfa-ketokwasów o rozgałęzionym łańcuchu , który normalnie przekształca leucynę , izoleucynę lub walinę w pochodne acylo-CoA , przekształca hipoglicynę A w wysoce toksyczny MCPA - CoA . Kofaktor FAD niezbędny do beta-oksydacji kwasów tłuszczowych wiąże się z węglem alfa MCPA-CoA, tworząc nieodwracalny kompleks, który wyłącza enzym. Ponadto MCPA-CoA blokuje niektóre enzymy wymagane do glukoneogenezy .
Uważa się, że zmniejszenie glukoneogenezy i utleniania kwasów tłuszczowych jest przyczyną większości objawów jamajskiej choroby wymiotnej. Zablokowanie metabolizmu kwasów tłuszczowych powoduje, że komórki zaczynają wykorzystywać glikogen jako źródło energii. Po wyczerpaniu glikogenu organizm nie jest w stanie wyprodukować więcej, co prowadzi do ciężkiej hipoglikemii. Te efekty biochemiczne są wykrywane przez nadmiar średniołańcuchowych kwasów tłuszczowych w moczu i kwasicę . Kluczowe terapie mają na celu obejście lub przeciwdziałanie zmianom biochemicznym i obejmują płyny dożylne i glukozę oraz hemodializę w przypadku niewydolność nerek .
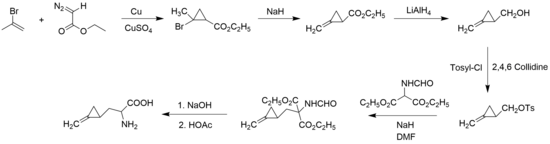
Synteza
W 1958 roku John Carbon, William Martin i Leo Swett jako pierwsi zsyntetyzowali hipoglicynę A w postaci racemicznej , wychodząc z 2-bromopropenu i diazooctanu etylu , tworząc pierścień cyklopropanu .
W 1992 roku Jack Baldwin , Robert Adlington, David Bebbington i Andrew Russell przeprowadzili pierwszą asymetryczną całkowitą syntezę poszczególnych diastereoizomerów hipoglicyny A, stosując epoksydację Sharplessa, aby umożliwić asymetryczną syntezę metylenocyklopropanu. 1H NMR i badania dichroizmu kołowego identyfikują główny diastereoizomer naturalnej hipogycyny A jako (2S , 4R ) i drugorzędny diastereoizomer jako (2S , 4S ) .